
Monitorowanie przebiegu procesu fermentacji alkoholowej
WPROWADZENIE
Fermentacja alkoholowa jest jednym z rodzajów oddychania beztlenowego. W wyniku fermentacji zostaje uwolniona energia zgromadzona w cząsteczkach cukrów i innych związków organicznych. Nie wymaga dostępu tlenu, chociaż niekiedy może przebiegać w jego obecności. Nie korzysta również z cyklu Krebsa czy też łańcucha transportu elektronów, wykorzystuje cząsteczkę organiczną jako ostateczny akceptor elektronów. Fermentacja alkoholowa rozpoczyna się od glikolizy cząsteczki glukozy z utworzeniem dwóch cząsteczek kwasu pirogronowego, które w dalszej kolejności ulegają redukcji do dwóch cząsteczek etanolu. Końcowym produktem fermentacji alkoholowej jest etanol i CO2. Fermentacja alkoholowa przebiega przy udziale różnych gatunków bakterii i drożdży.
Fermentacja alkoholowa jest procesem biotechnologicznym służącym do wytwarzania etanolu na skalę przemysłową. Wykorzystuje się w niej drożdże Saccharomyces jako biokulturę oraz wodny roztwór cukrów prostych (monosacharydów) jako płynne podłoże hodowlane. Efektywność fermentacji zależy od rodzaju i ilości monosacharydów w roztworze.
Drożdże wykorzystywane w produkcji napojów alkoholowych posiadają względną zdolność do wzrostu w warunkach beztlenowych. Przy pełnym dostępie tlenu drożdże przechodzą na oddychanie tlenowe, którego produktami są CO2 i woda. Gdy dostęp tlenu jest utrudniony, zachodzi fermentacja z utworzeniem etanolu i CO2.
Monitorowanie procesu biotechnologicznego – podstawa pomiaru
Próbkę pobraną z fermentatora sączy się w celu usunięcia komórek drożdży. Do przesączu dodaje się kwasu 3,5-dinitrosalicylowego, która zabarwia próbkę na żółto. Kwas 3.5-dinitorsalicylowy ogrzewany w obecności glukozy przekształca się w kwas 3-amino-5-nitrosalicylowy o barwie czerwonobrązowej. Ostateczna barwa roztworu zależy od zawartości glukozy: im więcej glukozy tym ciemniejsza próbka. Intensywność zabarwienia mierzy się za pomocą spektrometru SpectraTM przy użyciu diody emitującej światło niebieskie.
ODCZYNNIKI
- roztwór kwasu 3,5-dinitrosalicylowego (DNS)
Rozpuścić 10 g DNS w 200 cm3 roztworu NaOH o stężeniu 2 mol dm-3, mieszając i ogrzewając mieszaninę. Dodać stabilizatora barwnika – roztworu KNaC4H4O6 · 4H2O sporządzonego przez rozpuszczenie 300 g KNaC4H4O6 · 4H2O w 500 cm3 wody destylowanej. Zmieszać ze sobą oba roztwory i uzupełnić do objętości 1 dm3 za pomocą wody destylowanej.
ZAGROŻENIA
 |
Kwas 3,5 – dinitrosalicylowy, Xn
R: 20/21/22
S: 24/25
|
SPOSÓB POSTĘPOWANIA
Bioreaktor
Przygotuj fermentator do procesu beztlenowego z mobilną biolulturą. Zaopatrz fermentator w wylot dwutlenku węgla.
Podłoże hodowlane (pożywka)
Sporządź 5 kg 13% wodnego roztworu glukozy.
Biokultura
Przygotuj zawiesinę drożdży w wodzie (4 g drożdży na 5 litrów wody). Zawiesina powinna zawierać około 2·108 komórek drożdży na 1 cm3 roztworu.
Podstawowy roztwór standardowy glukozy
Przygotuj wodny roztwór glukozy o stężeniu γ(glu) = 15 mg cm-3
Przygotowanie próbki do pomiaru
Pobierz 10 cm3 zawartości fermentatora i przesącz próbkę aby usunąć komórki drożdży. Zmieszaj 1 cm3 przesączu z 9 cm3 wody destylowanej
Roztwory do wyznaczenia krzywej wzorcowej
Oznakuj pięć kolbek miarowych o pojemności 100 ml. Napełnij je zgodnie ze wskazówkami w poniższej tabeli:
Kolbka |
Podstawowy roztwór standardowy glukozy [cm3] |
Woda destylowana [cm3] |
Stężenie glukozy w roztworze
[mg cm-3] |
1 |
2 |
98 |
0,3 |
2 |
3 |
97 |
0,45 |
3 |
6 |
94 |
0,9 |
4 |
8 |
92 |
1,2 |
5 |
10 |
90 |
1,5 |
Po napełnieniu dobrze wymieszaj zawartość kolbki. W tabeli podano uzyskane stężenia masowe glukozy w roztworze.
POMIARY
Przygotuj siedem oznakowanych probówek i napełnij je według wskazówek w poniższej tabeli:
Probówka |
Roztwór DNS [cm3] |
Woda
destylowana
[cm3] |
1 cm3 roztworu wzorcowego z kolbki nr: |
Przesączona próbka z bioreaktora [cm3] |
0 |
1 |
3 |
|
|
1 |
1 |
2 |
1 |
|
2 |
1 |
2 |
2 |
|
3 |
1 |
2 |
3 |
|
4 |
1 |
2 |
4 |
|
5 |
1 |
2 |
4 |
|
S |
1 |
2 |
|
1 |
Ogrzewaj napełnione probówki we wrzącej wodzie przez 5 minut. Zajdzie reakcja glukozy z DNS i barwa próbki ulegnie zmianie – stanie się ciemniejsza. Po ochłodzeniu dodaj 6 cm3 wody destylowanej do każdej probówki. Teraz każda z nich zawiera po 10 cm3 barwnego roztworu. Wymieszaj zawartość, odmierz pipetą po 400 µl uzyskanych roztworów i umieść je w kolejnych zagłębieniach blistra. Próbka odniesienia znajduje się w probówce oznaczonej "0". Zmierz transmitancję za pomocą spektrometru SpektraTM względem próbki odniesienia, używając diody emitującej niebieskie światło.
WYNIKI
Tabela 1: Krzywa wzorcowa (A = f(γglu))
γglu [mg cm-3] |
0 |
0,15 |
0,3 |
0,45 |
0,9 |
1,2 |
1,5 |
A |
0,52 |
0,57 |
0,63 |
0,65 |
0,72 |
0,81 |
0,89 |
Wykres 1: Krzywa wzorcowa – zależność absorbancji od stężenia
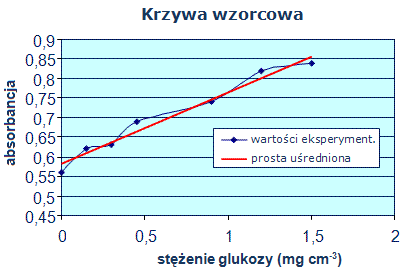
Tabela 2: Wyniki monitorowania przebiegu fermentacji przez 4 tygodnie
Warunki beztlenowe |
A |
γglu
[mg cm-3] |
start |
0,85 |
1,3 |
1
tydzień
|
0,68 |
0,7 |
2
tydzień
|
0,65 |
0,45 |
3
tydzień
|
0,60 |
0,25 |
4
tydzień
|
0,59 |
0,25 |
Zawartość glukozy w próbce = γglu (z wykresu) · 10
10: rozcieńczenie
A = absorbancja obliczona z transmitancji T: A = - log T
Opracowanie:
Alma Kapun Dolinar and Irena Štrumbelj Drusany, Boštjan Ozimek, Biotehniški izobraževalni center Ljubljana
|
