|

1. Wpływ stężenia jonów (CH3COO–) na powstawanie
jonów kompleksowych
[Fe3(OH)2(CH3COO)6]+
Bezpośrednio w zagłębieniach blistra przygotuj roztwór odniesienia oraz roztwory do badań o różnym stosunku jonów żelaza(III) do jonów octanowych. Odmierz wszystkie roztwory za pomocą kropli, zgodnie ze wskazówkami w poniższej tabeli. Zmierz wartości transmitancji (T) sporządzonych roztworów względem roztworu odniesienia, używając niebieskiej diody. Oblicz wartości absorbancji (A).
| |
R. odn. |
R. 1 |
R. 2 |
R. 3 |
R. 4 |
|
FeCl3, 0.1 mol dm-3 |
1  |
1  |
1  |
1  |
1  |
|
CH3COONa, 0.1 mol dm-3 |
- |
1  |
2  |
3  |
4  |
|
Woda dejonizowana |
8  |
7  |
6  |
5  |
4  |
|
n(CH3COO–)/n(Fe3+) |
- |
1 |
2 |
3 |
4 |
|
Absorbancja (A) |
- |
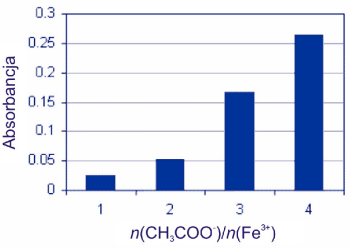
0,025 |
0,052 |
0,166 |
0,264 |
1  odpowiada w przybliżeniu 36 µl odpowiada w przybliżeniu 36 µl
Wyniki przedstawione na wykresie słupkowym przedstawiają wpływ stężenia jednego z substratów (jonu CH3COO–) na powstawanie pomarańczowego produktu [Fe3(OH)2(CH3COO)6]+. Reakcja pomiędzy octanem żelaza(III) a jonami octanowymi jest typowym przykładem reakcji równowagowej. Przy stechiometrycznym stosunku pomiędzy substratami n(CH3COO–)/ n(Fe3+) równym 2, tylko część substratów zostaje przekształcona w produkty. Wzrost stężenia jednego z substratów (jonu CH3COO–) powoduje wzrost wydajności produktu reakcji, co się przejawia istotnym wzrostem absorbancji roztworu.
Opracowanie: Nataša Gros, Uniwersytet w Lublanie, Wydział Chemii i Technologii Chemicznej
|
