|

2. Wpływ dodawania wspólnego jonu (H+) na powstawanie
jonów kompleksowych
[Fe3(OH)2(CH3COO)6]+
Przygotuj roztwór odniesienia i roztwory badane w zagłębieniach blistra. Zmieszaj jony żelaza(III) i jony octanowe w stosunku 1:4 we wszystkich badanych roztworach. Roztwory powinny się różnić jedynie stężeniem kwasu solnego. Zmierz transmitancję roztworów jak w doświadczeniu poprzednim i oblicz wartości absorbancji.
| |
Blank |
Sol. 1 |
Sol. 2 |
Sol. 3 |
Sol. 4 |
Sol. 5 |
|
FeCl3, 0.1 mol/L |
1  |
1  |
1  |
1  |
1  |
1  |
|
CH3COONa, 0.1 mol/L |
- |
4  |
4  |
4  |
4  |
4  |
|
Deionised water |
8  |
4  |
3  |
2  |
1  |
- |
|
HCl, 0.1 mol/L |
- |
- |
1  |
2  |
3  |
4  |
|
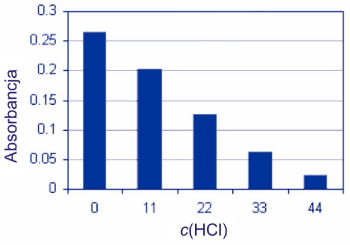
c(HCl) mmol/L |
- |
0 |
11 |
22 |
33 |
44 |
|
Absorbance |
- |
0.264 |
0.202 |
0.126 |
0.063 |
0.023 |
Wyniki przedstawione na poniższym wykresie słupkowym przedstawiają wpływ dodawania wspólnego jonu (H+) na równowagę chemiczną. Kwas solny powoduje rozkład jonu kompleksowego. Równowaga przesuwa się w lewo, w kierunku substratów w miarę wzrostu stężenia jonów wodorowych.
Opracowanie: Nataša Gros, Uniwersytet w Lublanie, Wydział Chemii i Technologii Chemicznej
|
