
10. Spektrometryczne oznaczenie glukozy
WPROWADZENIE
Istnieje wiele reakcji chemicznych, w których cukry tworzą z reagentami zabarwione produkty. Intensywność barwy zależy od stężenia cukru. Dlatego pomiar absorbancji i odniesienie do absorbancji roztworów wzorcowych może służyć do wyznaczania stężenia cukru. Tą metodą oznacza się przede wszystkim cukry proste, dla których opisano wiele reakcji barwnych, ma ona mniejsze zastosowanie do oznaczania polisacharydów. Oznaczenie całkowitej zawartości cukrów w produktach spożywczych polega na hydrolizie wszystkich cukrów za pomocą kwasu siarkowego(VI) H2SO4, zobojętnieniu roztworu wodorotlenkiem sodu NaOH i reakcji powstałych redukujących cukrów prostych z odczynnikiem DNS, w wyniku której powstają czerwono-brązowe produkty. Stężenie barwnych produktów określa się mierząc absorbancję roztworu za pomocą spektrometru SpektraTM używając niebieskiej diody.
PODSTAWA OZNACZENIA
W podwyższonej temperaturze odczynnik DNS (kwas 3,5-dinitrosalicylowy) reaguje z cukrami redukującymi z utworzeniem czerwono-brązowego produktu, kwasu 3-amino-5-nitrosalicylowego. Stężenie barwnego związku oznaczane jest przez pomiar absorbancji światła emitowanego przez niebieską diodę (540 nm) w spektrometrze SpektraTM.
APARATURA I ODCZYNNIKI
- spektrometr SpektraTM
- dżem owocowy
- odczynnik DNS (kwas 3,5dinitrosalicylowy)
- kwas siarkowy H2SO4 1,5mol dm-3
- 10% roztwór wodorotlenku sodu NaOH
- pipety
|
- kolby miarowe 100 ml
- probówki
- waga analityczna
- łaźnia wodna
- lejek
- sączek
|
Przygotowanie roztworu DNS
Odważ 10 g DNS i rozpuść go w 200 ml roztworu wodorotlenku sodu NaOH o stężeniu 2 mol dm-3. Ogrzej roztwór intensywnie mieszając. Przygotuj roztwór stabilizatora barwy winianu sodowo-potasowego (300 g winianu sodowo-potasowego w 500 ml wody destylowanej). Zmieszaj oba roztwory w kolbie miarowej o pojemności 1000 ml i dopełnij wodą destylowaną do kreski miarowej.
PRZYGOTOWANIE PRÓBKI
- Dżem – cukry
Odważ 1 – 2 g dżemu owocowego w kolbie stożkowej. Dodaj 10 ml roztworu kwasu siarkowego H2SO4 (1,5mol dm-3). Ogrzewaj zawartość kolby na łaźni wodnej przez 20 minut, mieszając od czasu do czasu. Ochłodź mieszaninę i ostrożnie dodaj 10% roztworu wodorotlenku sodu NaOH. Wymieszaj i przesącz powstałą mieszaninę do kolby miarowej o pojemności 100 ml, dopełnij wodą destylowaną do kreski miarowej. Przenieś 10 ml powstałego roztworu do innej kolby miarowej 100 ml i dopełnij wodą destylowana do kreski miarowej. Wymieszaj dobrze zawartość.
- Dżem – cukry redukujące
Odważ ok. 3 g dżemu w kolbie stożkowej, dodaj 50 ml wody destylowanej, ogrzewaj i mieszaj przez 10 minut. Mieszaninę przesącz do kolby miarowej o pojemności 100 ml, dopełnij wodą destylowaną do kreski miarowej. Przenieś 10 ml powstałego roztworu do innej kolby miarowej 100 ml i dopełnij wodą destylowana do kreski miarowej.
REAKCJE BARWNE I POMIARY
Bazowy roztwór wzorcowy glukozy
Odważ 1,5 g glukozy, przenieś do kolby miarowej 100 ml, dodaj wody destylowanej do kreski miarowej i wymieszaj. γ(glu) = 15 mg/ml
Roztwory kalibracyjne glukozy
Przygotuj 5 kolb miarowych o pojemności 100 ml i oznacz je odpowiednio. Do każdej z nich przenieś inną objętość bazowego roztworu wzorcowego glukozy, zgodnie z poniższą tabelą, i dopełnij zawartość każdej kolby wodą destylowaną do kreski miarowej.
|
kolba
|
1
|
2
|
3
|
4
|
5
|
|
bazowy roztwór wzorcowy glukozy [ml]
|
2
|
3
|
6
|
8
|
10
|
|
woda destylowana [ml]
|
98
|
97
|
94
|
92
|
90
|
Stężenia masowe roztworów kalibracyjnych glukozy są następujące:
|
kolba
|
1
|
2
|
3
|
4
|
5
|
|
stężenie masowe [mg cm-3]
|
0,3
|
0,45
|
0,9
|
1,2
|
1,5
|
Przygotuj sześć probówek i napełnij je zgodnie ze wskazówkami poniżej:
|
próbka
|
1
|
2
|
3
|
4
|
5
|
6
|
|
objętość roztworu kalibracyjnego [ml]
|
|
1
|
1
|
1
|
1
|
1
|
|
stężenie roztworu kalibracyjnego [mg cm-3]
|
|
0,3
|
0,45
|
0,9
|
1,2
|
1,5
|
|
objętość roztworu DNS [ml]
|
|
1
|
1
|
1
|
1
|
1
|
|
woda [ml]
|
10
|
2
|
2
|
2
|
2
|
2
|
Ogrzej probówki we wrzącej wodzie przez 5 minut, dzięki czemu zajdzie reakcja cukru z DNS z utworzeniem czerwono-brązowego produktu. Ochłodź probówki i dodaj do każdej z nich po 6 ml wody destylowanej. Wytrząśnij dobrze zawartość każdej probówki. Zmierz absorbancję powstałych roztworów używając niebieskiej diody (540nm).
OBLICZENIA
Oblicz stężenie glukozy w 100 g próbki w następujący sposób:
g
glukozy
/ 100 g
próbki
= γ
(glukozy) · 10 · 100
10 =
rozcieńczenie
100 =
objętość odpowiadająca 1 g próbki
POMIARY I WYNIKI
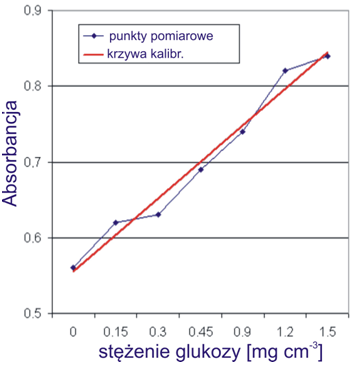
Tabela 1: Krzywa kalibracyjna – zależność absorbancji od stężenia
|
mass
concentration
(mg/mL)
|
absorbance
|
|
0
|
0.56
|
|
0.15
|
0.62
|
|
0.3
|
0.63
|
|
0.45
|
0.69
|
|
0.9
|
0.74
|
|
1.2
|
0.82
|
|
1.5
|
0.84
|
|
|
Rysunek 1: Krzywa kalibracyjna – zależność absorbancji od stężenia
Opracowanie: Alma Kapun Dolinar in Irena Štrumbelj Drusany, Srednja agroživilska šola Ljubljana
|

