
13. Oznaczanie zawartości etanolu w sokach owocowych
WPROWADZENIE
Przetwory owocowe i warzywne zawierają niewielkie ilości etanolu. Międzynarodowa norma ISO 2448 opisuje procedurę oznaczania etanolu w tych produktach, w skład której wchodzi destylacja i miareczkowanie. Etap destylacji jest niezbędny do usunięcia efektu matrycy, służy również wstępnemu zagęszczeniu oznaczanego składnika. Etanol w destylacie jest utleniany dichromianem(VI) potasu w obecności kwasu siarkowego(VI). Nieprzereagowany dichromian oznacza się przy pomocy miareczkowania mianowanym roztworem siarczanu żelaza(II) amonu wobec Fe(II)-1,10-fenantroliny jako wskaźnika. W obecnym ćwiczeniu miareczkowanie zostało zastąpione spektrometrycznym pomiarem po reakcji etanolu z dichromianem(VI) potasu.
ZADANIE
Przy pomocy spektrometru SpektraTM oznacz stężenie etanolu w destylacie z soku owocowego stosując reakcję etanolu z dichromianem(VI) potasu w obecności kwasu siarkowego(VI) i oblicz zawartość etanolu w jednym kilogramie soku.
SPRZĘT I ODCZYNNIKI
Do przeprowadzenia ćwiczenia niezbędne są:
- waga analityczna,
- zlewka 800 ml
- pehametr z kombinowaną elektrodą szklaną
- kolba destylacyjna 2000 ml
- zestaw do destylacji (Rys. 1)
- kolba miarowa 100 ml
- cylinder miarowy 10 ml
- termometr
- kamyczki wrzenne
- kolba miarowa 1000 ml
- zlewki różnej wielkości
- bagietka szklana
- lejek analityczny
- cylinder miarowy 500 ml
- mikropipeta (50-1000 µl)
- mikropipeta (100-5000 µl)
- spektrometr SpektraTM
- szklane probówki z korkami
- blistry
- tlenek wapnia CaO, (M = 56,08 g mol-1)
- dichromian(VI) potasu K2Cr2O7, (M = 294,19 g mol-1)
- kwas siarkowy(VI) H2SO4, (M = 98,08 g mol-1, ρ = 1,84 g cm-3, w = 0,96),
- pył aluminiowy Al, (M = 26,98 g mol-1)
- siarczan(VI) żelaza(II) amonu heksahydrat (NH4)2Fe(SO4)2· 6H2O
(M = 392,14 g mol-1)
- siarczan(VI) żelaza (II) heptahydrat FeSO4· 7H2O, (M = 278,02 g mol-1)
- 1,10- fenantrolina monohydrat, C12H8N2· H2O, (M = 198,2 g mol-1)
BEZPIECZEŃSTWO
Substancja |
Zwroty R i S |
Symbol |
Tlenek wapnia
|
R 41
Zagrożenie poważnego uszkodzenia oczu.
S 22-24-26-39
Nie wdychać pyłu. Unikać kontaktu ze skórą. W razie kontaktu z oczami, przemyć natychmiast obficie wodą i skontaktować się z lekarzem. Używać ochrony oczu/twarzy.
|
 |
Dichromian(VI) potasu
|
R 45-46-60-61- 8-21-25-26-34-42/43-48/23-50/53
Może wywoływać raka. Może powodować dziedziczone uszkodzenia genetyczne. Może obniżać płodność. Może uszkadzać płód. W kontakcie z palnymi substancjami może wywołać pożar. Szkodliwy w razie kontaktu ze skórą. Trujący w razie spożycia. Silnie trujący w razie wdychania. Wywołuje oparzenia. Może powodować nadmierną wrażliwość w razie wdychania i kontaktu ze skórą. Trujący: poważne zagrożenie dla zdrowia wskutek długotrwałego narażenia na wdychanie. Silnie trujący dla organizmów wodnych, może przynosić długotrwałe szkodliwe skutki dla środowiska wodnego.
S 53-45-60-61
Unikać narażenia – zapoznaj się ze specjalną instrukcją przed użyciem. W razie wypadku lub złego samopoczucia natychmiast skontaktować się z lekarzem (pokazać lekarzowi etykietę, jeżeli to możliwe). Tę substancja oraz pojemnik należy traktować jako odpady niebezpieczne. Unikać wprowadzania do środowiska. Zapoznaj się ze specjalną instrukcją / kartą bezpieczeństwa.
|


 |
Kwas siarkowy(VI)
|
R 35
Powoduje poważne oparzenia.
S 26-30-45
W razie kontaktu z oczami przemyć natychmiast obficie wodą i skontaktować się z lekarzem. Nigdy nie należy dodawać wody do tego produktu. W razie wypadku lub złego samopoczucia skontaktować się z lekarzem (pokazać etykietę jeżeli to możliwe.
|
 |
Etanol |
R 11
Łatwopalny.
S 7-16
Przechowywać w szczelnie zamkniętym pojemniku. Przechowywać z dala od źródeł ognia. Palenie wzbronione.
|
 |
Siarczan(VI) żelaza(II) heptahydrat |
R 22-36/38
Szkodliwy w razie spożycia. Działa drażniąco na oczy i skórę.
|
 |
Siarczan(VI) żelaza(II) amonu heksahydrat |
/ |
/ |
Pył aluminiowy |
R 11-15
Łatwopalny. W kontakcie z wodą wydziela łatwopalny gaz.
S 43
W razie pożaru gasić piaskiem. Nigdy nie używać wody.
|
 |
SPOSÓB POSTĘPOWANIA
Przygotowanie zawiesiny tlenku wapnia 0,1964 mol dm-3
W zlewce 500 ml odważ 110 g tlenku wapnia i dodaj wody dejonizowanej. Zawiesinę przenieś ilościowo do kolby miarowej 1000 ml i rozcieńcz zawiesinę wodą dejonizowaną do kreski miarowej.
Przygotowanie roztworu bazowego dichromianu(VI) potasu 0,1447 mol dm-3.
W zlewce odważ 42,5723 g dichromianu(VI) potasu, uprzednio wysuszonego przez 2 godziny w temperaturze 105°C. Dodaj wody dejonizowanej i rozpuść sól na łaźni ultradźwiękowej. Roztwór przenieś ilościowo do kolby miarowej 1000 ml i rozcieńcz zawiesinę wodą dejonizowaną do kreski miarowej.
Przygotowanie roztworu 1:1 kwasu siarkowego(VI)
Przy pomocy cylindra miarowego odmierz 200 ml wody dejonizowanej do zlewki o pojemności 1000 ml. Umieść zlewkę w zimnej łaźni wodnej, powoli i ostrożnie dodaj 200 ml stężonego kwasu siarkowego(VI).
Destylacja
Odważ 700 g soku owocowego do zlewki o pojemności 800 ml i zmierz pH płynu. Skoryguj pH do wartości 8,0±0,2 przy pomocy zawiesiny wodorotlenku wapnia. Przenieś roztwór ilościowo do kolby destylacyjnej o pojemności 2000 ml, dodaj kamyczki wrzenne i zmontuj aparaturę zgodnie z Rys. 1. Jako odbieralnik zastosuj kolbę miarową o pojemności 100 ml zawierającą 10 ml wody dejonizowanej. Utrzymuj temperaturę odbieralnika w granicach 15 - 20ºC aby zapobiec odparowaniu etanolu. Zatrzymaj destylację po zebraniu około 80 ml destylatu. Rozmontuj aparaturę do destylacji, spłukując wewnętrzne ścianki kilkoma mililitrami wody dejonizowanej do odbieralnika. Rozcieńcz destylat wodą dejonizowaną do kreski miarowej.

Rysunek 1: Aparatura do destylacji etanolu z produktów owocowych i warzywnych
Oznaczenie etanolu poprzez pomiar absorbancji roztworu dichromianu(VI) potasu, który przereagował z roztworem etanolu.
Przy pomocy mikropipety odmierz 0,3 ml bazowego roztworu dichromianu(VI) potasu 0,1447 mol dm-3 do probówki, dodaj 2 ml roztworu 1:1 kwasu siarkowego(VI) i 1 ml roztworu kalibracyjnego etanolu lub destylatu. Przygotuj próbkę odniesienia w podobny sposób zastępując roztwór etanolu oraz dichromianu(VI) potasu wodą dejonizowaną. Zamknij probówki. Rysunek 2 i 3 przedstawiają probówki z dichromianem(VI) potasu i kwasem siarkowym(VI) odpowiednio przed i po dodaniu roztworu etanolu. Czas reakcji etanolu z dichromianem wynosił 30 minut.

Rysunek 2: Probówki zawierające po 0,3 ml roztworu dichromianu(VI) potasu i po 2 ml roztworu 1:1 kwasu siarkowego(VI) przed dodaniem roztworu etanolu.

Rysunek 3: Probówki zawierające po 0,3 ml roztworu dichromianu(VI) potasu i po 2 ml roztworu 1:1 kwasu siarkowego(VI) 30 minut po dodaniu 1 ml roztworu etanolu o różnym stężeniu
Po upływie 30 minut od dodania roztworu etanolu do probówek, przenieś po 400 µl roztworów do zagłębień blistra i zmierz transmitancję przy pomocy spektrometru SpektraTM używając diody emitującej niebieskie światło. Wyniki pomiarów przedstawia Tabela 1.
Tabela 1: Wartości transmitancji i absorbancji roztworów dichromianu(VI) potasu mierzone względem próbki odniesienia przy użyciu diody emitującej niebieskie światło w 30 minut po dodaniu kalibracyjnych roztworów o różnym stężeniu etanolu lub po dodaniu destylatu z próbek soków.
c (C2H5OH)
[mmol dm-3] |
0 |
3,4 |
10,5 |
17,5 |
24,5 |
31,5 |
38,5 |
45,5 |
Sok z czarnej porzeczki
|
Sok
anana-sowy |
T |
20,9 |
21,3 |
22,1 |
25 |
27,2 |
31,3 |
34,5 |
41,4 |
23,3 |
20,0 |
A |
0,6799 |
0,6716 |
0,6556 |
0,6021 |
0,5654 |
0,5045 |
0,4622 |
0,3830 |
0,6326 |
0,6990 |
WYNIKI
Zależność absorbancji dichromianu od stężenia etanolu przedstawia Rys. 4. Stężenie etanolu w destylatach można odczytać z wykresu na podstawie zmierzonej absorbancji lub obliczyć przy pomocy równania krzywej. Wyniki obliczone na podstawie danych z Tabeli 1 zostały przedstawione w Tabeli 2.
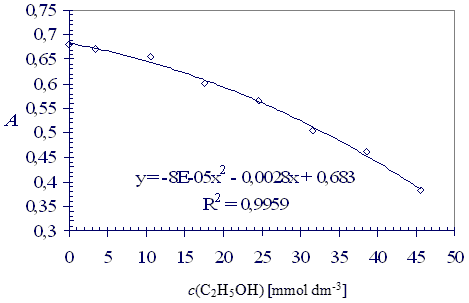
Rysunek 4: Zależność absorbancji dichromianu od stężenia etanolu
Tabela 2: Stężenie etanolu w destylatach z soków owocowych
Destylat
|
c (C2H5OH)
[mmol dm-3]
|
Sok z czarnej porzeczki
|
13,1 |
Sok ananasowy
|
0 |
Zawartość etanolu w 1 kilogramie soku owocowego można obliczyć na podstawie oznaczonego stężenia etanolu w destylacie (c(EtOH)) przez pomnożenie stężenia przez objętość destylatu (0,1 dm3) i podzielenie przez masę soku owocowego wziętego do destylacji (msok), zgodnie z poniższym równaniem.
n(EtOH) |
= |
c(EtOH)·0,1dm3 |
|
|
kg |
msok |
Kilogram soku z czarnej porzeczki zawiera 1,87 milimoli etanolu.
Opracowanie: Dr. Nataša Gros, Karmen Lampreht, Uniwersytet w Lublanie, Wydział Chemii i Technologii Chemicznej
|




