|
PRAWO LAMBERTA-BEERA – UCZENIE PRZEZ EKSPERYMENTCelCelem tego ćwiczenia jest wyprowadzenie prawa Lamberta-Beera metodą uczenia przez eksperyment.
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Φ - moc promieniowania |
Φi = ? |
| Transmitancja: T = Φi / Φ0 |
Φ0 |
Przedstaw wyniki na poniższym wykresie.
Zdefiniuj zależność pomiędzy transmitancją a długością drogi światła (b) przez próbkę.
T ∝
Doświadczenie 2: Wpływ wzrostu stężenia roztworu (c) na transmitancję
Celem doświadczenia jest określenie zależności pomiędzy transmitancją a stężeniem roztworu.
Zagrożenia
|
|
Manganian(VII) potasu KMnO4 jest substancją szkodliwą, jeżeli dostanie się do organizmu przez przewód pokarmowy, drogi oddechowe lub przez skórę. Jest silnym utleniaczem, który energicznie reaguje z substancjami organicznymi. Podczas pracy z tym odczynnikiem używaj okularów ochronnych oraz fartucha laboratoryjnego. Nie wprowadzaj tej substancji do środowiska. |
|
|
|
|
|
Procedura
Bezpośrednio w zagłębieniach blistra sporządź dziewięć roztworów KMnO4 o różnych stężeniach, zgodnie z wskazówkami zawartymi w poniższej tabeli. Zmierz transmitancję względem wody dejonizowanej, używając zielonej diody. Przedstaw wyniki w formie wykresu.

|
KMnO4( |
-* |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
| H2O ( |
9 |
8 |
7 |
6 |
5 |
4 |
3 |
2 |
1 |
0 |
Niebieskie tło oznaczone * dotyczy roztworu odniesienia.
Stężenie wyjściowego roztworu KMnO4 wynosi 10 mmol dm-3.
Przedstaw wyniki na poniższym wykresie.
Zdefiniuj zależność pomiędzy transmitancją a stężeniem roztworu (c).
T ∝
Doświadczenie 3: Wpływ rodzaju substancji na transmitancję
Celem tego doświadczenia jest przedstawienie w jaki sposób zmienia się transmitancja roztwory, gdy jony dichromianowe(VI) przekształcają się w jony chromianowe(VI).
| Cr2O72–+ 2 OH– |
|
2 CrO42–+ H2O |
| (pomarańczowy) |
|
(żółty) |
Hazards
|
|
Wodorotlenek sodu NaOH jest substancją żrącą, które może spowodować oparzenia oczu, skóry oraz przewodu pokarmowego. Unikaj kontaktu ze skórą i z oczami. Podczas pracy z odczynnikiem używaj okularów ochronnych i fartucha laboratoryjnego. |
|
|
Dichromian(VI) potasu K2Cr2O7 jest silnie trujący i szkodliwy dla środowiska. Kontakt ze skórą może spowodować jej nadwrażliwość. W razie spożycia wykazuje działanie trujące. Podczas pracy z odczynnikiem używaj okularów ochronnych i fartucha laboratoryjnego. Nie wprowadzaj tej substancji do środowiska. |
|
|
|
|
|
Procedura
W zagłębieniach blistra przygotuj roztwór odniesienia oraz pięć roztworów dichromianu(VI) potasu o różnych stężeniach. Przygotuj również roztwór odniesienia oraz pięć roztworów chromianu(VI) potasu o różnych stężeniach. Postępuj zgodnie ze wskazówkami zawartymi w poniższej tabeli, używając wyjściowego roztworu K2Cr2O7 o stężeniu 11 mmol dm-3, wody dejonizowanej oraz wyjściowego roztworu NaOH o stężeniu 2 mol dm-3.
|
|
R. odnies. |
Roztwory dichromianu(VI) potasu |
||||
| K2Cr2O7( |
- |
1 |
2 |
3 |
4 |
5 |
| NaOH ( |
- |
- |
- |
- |
- |
- |
| H2O ( |
9 |
8 |
7 |
6 |
5 |
4 |
|
|
R. odnies. |
Roztwory chromianu(VI) |
||||
| K2Cr2O7( |
- |
1 |
2 |
3 |
4 |
5 |
| 6
NaOH ( |
2 |
2 |
2 |
2 |
2 |
2 |
| H2O ( |
7 |
6 |
5 |
4 |
3 |
2 |
Zmierz transmitancję roztworów dichromianu(VI) i chromianu(VI) względem roztworów odniesienia za pomocą spektrometru SpektraTM, używając niebieskiej diody. Wyniki przedstaw na wykresie.
Przedstaw wyniki na poniższym wykresie.
Jeżeli do części wykładniczej zależności T ∝ e-cb wprowadzimy współczynnik proporcjonalności k, zależny od rodzaju substancji, otrzymamy następujące równanie:
T =
W zastosowaniach praktycznych w chemii raczej unika się wykładniczej zależności mierzonej wartości fizycznej od stężenia. Zależności liniowe są bardziej pożądane.
Zależność wykładniczą T ∝ e-kcb można przekształcić w liniową poprzez wyciągnięcie logarytmów naturalnych obu stron równania. W kolejnym etapie, logarytm naturalny można przekształcić w logarytm dziesiętny dzieląc go przez 2,303. Wyrażenie k/2,303 nosi nazwę molowego współczynnika absorpcji i jest oznaczane symbolem ε, natomiast wyrażenie -logT nosi nazwę absorbancji i jest oznaczane symbolem A. Powstałą zależność nazywamy prawemLamberta – Beera.
|
A = ε c b |
Prawo Lamberta – Beera
Symbol A oznacza absorbancję, c oznacza stężenie molowe roztworu [mol dm-3], b oznacza długość drogi światła przez próbkę [cm]. Symbol ε oznacza molowy współczynnik absorpcji substancji dla określonej długości fali świetlnej i określonych warunków. Z równania możemy wyprowadzić, że jednostką molowego współczynnika absorpcji jest dm3 mol-1 cm-1.
Uzupełnij następującą zależność pomiędzy absorbancją i transmitancją. (Wskazówka. Absorbancja jest związana z transmitancją w podobny sposób jak pH jest związane ze stężeniem jonów hydroniowych [H3O+] w roztworze).
| A = ________T |
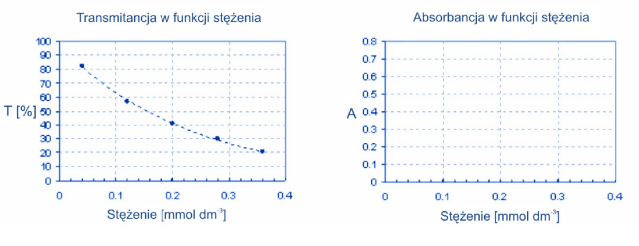
Oblicz wartości absorbancji, wykorzystując podane w tabeli wartości transmitancji. Transmitancję możemy wyrazić jako liczbę ułamkową lub jako procent. Do obliczeń absorbancji należy używać wartości transmitancji wyrażonej w postaci ułamka.
| c (mmol dm-3) |
0,04 |
0,12 |
0,20 |
0,28 |
0,36 |
| T |
0,826 |
0,570 |
0,408 |
0,298 |
0,205 |
| A |
|
|
|
|
|
Wykres po lewej przedstawia zależność transmitancji roztworów pewnej substancji od stężenia. W diagramie po prawej sporządź wykres przedstawiający zależność absorbancji roztworów tej substancji od stężenia.
Opracowanie: Nataša Gros, Uniwersytet w Lublanie, Wydział Chemii i Technologii Chemicznej oraz Margareta Vrtačnik, Uniwersytet w Lublanie, Wydział Nauk Przyrodniczych i Inżynierii