|

OZNACZENIE ZAWARTOŚCI MANGANU W STALI
Zadanie
Sporządzenie krzywej kalibracyjnej i określenie zawartości manganu w próbkach stali konstrukcyjnej niskostopowej.
Wprowadzenie
Stal jest stopem żelaza z węglem i innymi pierwiastkami.
Rodzaje stali klasyfikuje się ze względu na różne parametry:
- sposób otrzymywania (konwerter Bessemera, piec elektryczny do recyklingu złomu. piec Siemensa-Martina).
- skład:
- Stal węglowa (głównym dodatkiem stopowym jest węgiel o zawartości poniżej 1% tego pierwiastka)
- Stal stopowa, zawiera inne pierwiastki dodawane w celu osiągnięcia pożądanych właściwości. Rozróżnia się stal niskostopową (do 5% innych składników) i wysokostopową (powyżej 5%).
- Stal nierdzewna, rodzaj stali wysokostopowej w której oprócz węgla i innych pierwiastków znajduje się co najmniej 11,5% chromu.
- przeznaczenie:
- Stal konstrukcyjna, zawiera najczęściej nie więcej niż 0,6% węgla, który jest głównym (poza żelazem) składnikiem stopu. Przeznaczona jest przede wszystkim do budowy konstrukcji stalowych.
- Szlachetna stal konstrukcyjna, oprócz węgla zawiera mangan, krzem, chrom, nikiel, molibden, wanad. Jest wykorzystywana do budowy złożonych konstrukcji i części maszyn.
- Stal narzędziowa, zawiera więcej niż 0,6% węgla oraz chrom, wolfram, wanad, molibden, kobalt i inne. Wytwarza się z niej narzędzia.
Pierwiastków takich jak azot, tlen, fosfor czy siarkę nie uważa się za składniki stopowe lecz za zanieczyszczenia, przedostające się do stali podczas procesu produkcji, studzenia i przetwarzania.
Składnikami stali stopowych są mangan, molibden, krzem, glin, kobalt, wolfram, wanad, tytan, nikiel i wiele innych, które są dodawane aby zrekompensować niekorzystny wpływ zanieczyszczeń, np. chrom, mangan, wolfram, molibden i tytan reagując z węglem w stali tworzą węgliki.
Zasada oznaczenia
Rozpuść opiłki stali w mieszaninie kwasów: dodaj kwasu siarkowego(VI), azotowego(V) i fosforowego(V) i ogrzewaj mieszaninę. Zarówno żelazo jak i mangan reagują z kwasami wypierając wodór.
2 Fe(s) + 6H3O+(aq)
→
3H2(g) + 2 Fe3+(aq) + 6 H2O(l)
Mn(s) + 2 H3O+(aq) → H2(g) + Mn2+(aq) + 2 H2O(l)
Kwas fosforowy(V) reaguje z żółtymi jonami żelaza(III) z utworzeniem bezbarwnego związku kompleksowego. Jony manganu(II) są utleniane do fioletowych jonów manganianowych przy pomocy jodanu(VII) potasu KIO4(s).
2 Mn2+(aq) + 5 IO4–(aq) + 9 H2O(l) → 2 MnO4–(aq) + 5 IO3–(aq) + 6 H3O+(aq)
Zawartość mangany w próbce oznacza się spektrofotometrycznie.
Sprzęt i odczynniki
Odczynniki:
- kwas siarkowy(VI), ψ(H2SO4/H2O) = 1:3
- kwas fosforowy(V), stężony
- kwas azotowy(V), ψ(HNO3/H2O) = 1:1
- jodan(VII) potasu cz.d.a.
- azotan(III) sodu,
w(NaNO2) = 0,02
- manganian(VII) potasu cz.d.a.
Sprzęt laboratoryjny:
- zlewka 150 ml,
- szkiełko zegarkowe Ф80,
- cylinder miarowy 10 ml,
- pipeta miarowa 10 ml,
- pipeta miarowa 5 ml,
- cylinder miarowy 50 ml,
- kolba miarowa 50 ml,
- waga analityczna,
- waga laboratoryjna
- elektryczna płytka grzejna,
- wyciąg,
- spektrometr SpektraTM z wyposażeniem,
- blistry,
- buteleczki plastikowe 10 ml z wkraplaczami.
ZAGROŻENIA
|
kwas siarkowy(VI)
R: 35, S: 26-30-45
|
|
kwas azotowy(V)
R: 8-35, S: 23-26-36-45
|
|
kwas foforowy (V)
R: 34 S (1/2)-26-45
|
|
manganian(VII) potasu
R: 22, 8, 50/53 S: 60, 61
|
 |
|
azotan(III) sodu
R: 8-25 S: 44
|
Sposób postępowania
Przygotowanie roztworu bazowego:
Odważ 0,7191 g KMnO4, rozpuść w przegotowanej i schłodzonej wodzie dejonizowanej i uzupełnij zawartość wodą do kreski miarowej w kolbie miarowej 250 ml. Przenieś 10 ml roztworu do kolby miarowej 500 ml i rozcieńcz zawartość do kreski miarowej. Zawartość manganu w tak otrzymanym roztworze wynosi 20 μg cm-3. Zdekantuj świeżo przyrządzony roztwór do plastikowej buteleczki 10 ml wyposażonej we wkraplacz.
Przygotowanie odczynników:
- Kwas siarkowy(VI), ψ(H2SO4/H2O)=1:3
Odmierz w cylindrze 30 ml wody destylowanej, przelej ją do zlewki 50 ml. Dodaj 10 ml stężonego kwasu siarkowego(VI), chłodząc zawartość zlewki.
- Kwas azotowy(V), ψ(HNO3/H2O)=1:1
Odmierz 10 ml wody do zlewki 50 ml i dodaj 10 ml kwasu azotowego(V).
- Azotan(III) sodu, w(NaNO2)=0.02
Na wadze laboratoryjnej odważ 1,00 g azotanu(III) sodu w zlewce 100 ml, dodaj wody destylowanej do masy 50,00 g
Przygotowanie próbki:
Wszystkie pomiary należy przeprowadzić trzykrotnie.
Odważ na wadze analitycznej około 0,1 g opiłków stalowych w zlewce 150 ml (zapisz wyniki ważenia w tabeli), dodaj 10 ml roztworu kwasu siarkowego(VI) i kilka kamyczków wrzennych. Przykryj zlewkę szkiełkiem zegarkowym i ogrzewaj pod wyciągiem na płytce elektrycznej do rozpuszczenia opiłków.
Następnie zdejmij zlewkę z płytki grzejnej i dodaj 2 ml roztworu kwasu fosforowego(V).
Po ochłodzeniu roztworu dodaj 0,5 ml kwasu azotowego(V). Jeżeli w roztworze znajdują się cząstki grafitu, nie będą one przeszkadzać w analizie.
Ogrzej roztwór do pojawienia się białych dymów. Ochłodź roztwór, dodaj ok. 20 ml wody destylowanej i dwie łyżeczki laboratoryjne jodanu(VII) potasu.
Ogrzej roztwór ponownie na płytce grzejnej. Jeżeli stal zawierała mangan, roztwór zabarwia się na fioletowo.
Przenieś ilościowo zawartość zlewki do kolbki miarowej 50 ml i rozcieńcz do kreski miarowej.
Otrzymany roztwór nadaje się do analizy spektrometrycznej. Wlej roztwór do plastikowej buteleczki 10 ml z wkraplaczem.
W innej buteleczce umieść kilka mililitrów otrzymanego roztwór i dodaj 5 kropli roztworu azotanu(III) sodu. Odbarwiony w ten sposób roztwór użyj jako próbki odniesienia w pomiarach transmitancji.
Pomiary spektrometryczne:
- Przygotuj próbkę odniesienia i osiem roztworów kalibracyjnych zgodnie ze wskazówkami w Tabeli 1.
Tabela 1:
roztw. kalibr.
|
0 (próbka odn.) |
1
|
2
|
3
|
4
|
5
|
6
|
7
|
8
|
Próbka
|
woda dest. (krople) |
10
|
9
|
8
|
7
|
6
|
5
|
4
|
3
|
2
|
0
|
roztwór bazowy (krople)
|
0
|
1
|
2
|
3
|
4
|
5
|
6
|
7
|
8
|
0
|
Št. Kap. vzorca |
-
|
-
|
-
|
-
|
-
|
-
|
-
|
-
|
-
|
10
|
T [%]
|
|
|
|
|
|
|
|
|
|
|
A |
|
|
|
|
|
|
|
|
|
|
γ (Mn)
[μg cm-3]
|
0
|
2
|
4
|
6
|
8
|
10
|
12
|
16
|
18
|
|
- Zmierz transmitancję używając diody emitującej zielone światło względem próbki odniesienia, dla której ustaw wartość transmitancji 100,0.
- Zapisz wyniki pomiarów w tabeli.
- Oblicz wartości absorbancji, zapisz je w tabeli.
- Zastosuj oprogramowanie Excel do wyznaczenia krzywej kalibracyjnej i wyprowadzenia równania otrzymanej prostej.
Przykład krzywej kalibracyjnej:
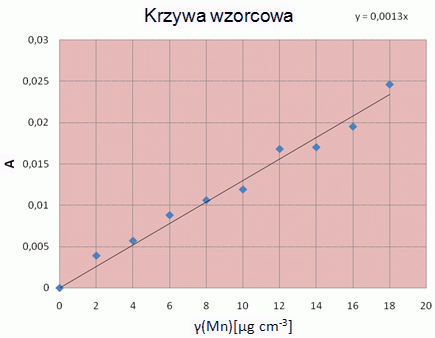
Odczytaj zawartość manganu z krzywej kalibracyjnej lub oblicz ją korzystając z równania prostej.
Tabela 2:
Próbka
|
masa próbki
[g]
|
A
|
γ(Mn
Mn)
[μg cm -3]
|
1 |
|
|
|
2 |
|
|
|
3 |
|
|
|
Obliczenia
Oblicz procentową zawartość manganu w stali (procent wagowy).
w(Mn,%) = |
γ(Mn).V(próbka).100 |
m(próbka) |
Wynik
Tabela 3:
opis próbki stali |
procentowa zawartość manganu
|
|
|
Opracowanie: Romana Mele, Helena Prevc, ŠC SSKŠ Ljubljana
|