|

OZNACZANIE ILOŚCIOWE JONÓW CHROMU(III) I KOBALTU(II) OBOK SIEBIE
Cel
Celem ćwiczenia jest jednoczesne oznaczenie zawartości jonów chromu(III) i kobaltu(II) w roztworze wodnym metodą spektrofotometryczną.
Wprowadzenie
1. Podstawy spektrofotometrii UV-VIS
Promieniowanie elektromagnetyczne przechodzące przez dany ośrodek może ulec absorpcji, odbiciu i rozproszeniu. W metodach spektrofotometrycznych wykorzystuję się zjawisko absorpcji promieniowania. Warunkiem wystąpienia tego zjawiska jest, aby energia padającego promieniowania odpowiadała różnicy energii poziomów energetycznych elektronów w absorbującej cząsteczce lub jonie, tzn. aby elektrony mogły być przeniesione ze stanu podstawowego do stanu wzbudzonego. W przypadku przejść elektronowych energia ta odpowiada najczęściej promieniowaniu w zakresie nadfioletu (UV, 200-380 nm) i światła widzialnego (VIS, 380-780 nm). Długość fali absorbowanego promieniowania zależy od struktury elektronowej cząsteczki lub jonu. W substancjach bezbarwnych (białych), elektronowe poziomy energetyczne są znacznie oddalone od siebie, dlatego takie substancje absorbują promieniowanie o wyższej energii (nadfioletowe). Natomiast w substancjach barwnych elektronowe poziomy energetyczne znajdują się bliżej siebie, co skutkuje absorpcją w zakresie światła widzialnego.
Metodami spektrometrycznymi można badać:
- bezbarwne związki organiczne absorbujące w zakresie nadfioletu (posiadające elektrony typu p lub n, np. węglowodory aromatyczne, aldehydy, ketony, kwasy karboksylowe, aminy)
- niektóre bezbarwne związki nieorganiczne (np. pierwiastków ziem rzadkich, ozon, tlenek siarki(IV))
- barwne związki organiczne (posiadające układy sprzężonych wiązań podwójnych, np. barwniki organiczne)
- barwne związki nieorganiczne (związki metali przejściowych, np. manganian(VII) potasu, siarczan(VI) miedzi(II))
- substancje, które wskutek reakcji chemicznych (np. kompleksowania) przekształcają się w substancje barwne
2. Spektrometria UV-VIS jako metoda analizy ilościowej
Do scharakteryzowania intensywności absorpcji promieniowania używa się dwóch podstawowych wielkości: transmitancji (T) i absorbancji (A). Transmitancję definiujemy jako stosunek intensywności promieniowania monochromatycznego po przejściu przez próbkę (I) do jego intensywności początkowej (I0).
T = I/I0
Transmitancja wskazuje, jaka część promieniowania padającego przeszła przez próbkę. Często wartość transmitancja podawana jest w procentach. T = I/I0·100%. Absorbancja (A) jest z kolei określona przez równanie:
A = log 1/T = - log T
Prawo Lamberta-Beera mówi, że dla danej długości fali świetlnej λ, absorbancja Aλ jest wprost proporcjonalna do stężenia c (w mol dm-3) absorbującej substancji w roztworze oraz długości drogi promieniowania przez próbkę l (w cm)
Aλ = ελ·l·c
gdzie eλ jest współczynnikiem proporcjonalności dla fali λ, wyrażonym w jednostkach dm3 mol-1 cm-1. Wykres zależności absorbancji od stężenia dla danej długości fali jest prostoliniowy, współczynnik nachylenia prostej odpowiada eλ·l.
Jeżeli w roztworze znajduje się więcej niż jedna substancja absorbująca promieniowanie o danej długości fali, prawo Lamberta-Beera przewiduje, że wartości absorbancji poszczególnych składników sumują się:
A = A1+A2+A3+.....+An = (ε1·c1+ε2·c2+ε3·c3+.....+ε n·cn)·l
Odczynniki
- Azotan(V) kobaltu(II) heksahydrat, Co(NO3)2 · 6 H2O
- Azotan(V) chromu(III) nonahydrat, Cr(NO3)3 · 9 H2O
Materiały i sprzęt laboratoryjny
- spektrometr
SpektraTM
- blistry
- plastikowe buteleczki z zakraplaczem
- kolbki miarowe poj. 50 cm3
Zagrożenia
|
Azotan(V) kobaltu(II) heksahydrat jest trucizną i substancją rakotwórczą, może wywoływać alergie. Unikaj kontaktu ze skórą i wdychania pyłu. R: 42/43, 49, 50/53, 60, 68; S: 22, 36/37, 45, 53, 61. |
 |
|
Azotan(V) chromu(III) nonahydrat działa drażniąco na oczy i skórę, może intensyfikować pożar. Unikaj kontaktu ze skórą i oczami. R: 8, 36/38; S: 26. |
 |
Procedura
1. Przygotowanie roztworów wzorcowych
W kolbkach miarowych o pojemności 50 cm3 sporządzamy roztwory o odpowiednich stężeniach poprzez rozcieńczenie roztworów podstawowych (osobno dla kobaltu i osobno dla chromu) w proporcjach zawartych w poniższej tabeli:
Co(NO3)2 · 6 H2O |
65 [g dm-3] |
|
Roztwory podstawowe
|
Cr(NO3)3· 9 H2O |
120 [g dm-3] |
Nr |
Co2+ |
Cr3+ |
V [cm3] |
c [mol dm-3] |
V [cm3] |
c [mol dm-3] |
1. |
0,5 |
|
5 |
|
2. |
1,5 |
|
10 |
|
3. |
2,5 |
|
15 |
|
4. |
3,5 |
|
20 |
|
5. |
4,5 |
|
25 |
|
Wpisz w tabeli stężenia uzyskanych roztworów.
Wskazówka: Wyznaczone stężenia w jednostkach g dm-3 przeliczamy na jednostkę mol dm-3 dzieląc uzyskane wyniki przez masę molową odpowiedniej substancji (sól kobaltu M1=…………,
sól chromu M2= ……………..).
2. Dobór odpowiedniej diody
Aby dobrać odpowiednią diodę (długość fali promieniowania widzialnego) dla wodnego roztworu soli kobaltu oraz chromu, do dwóch zagłębień blistra nalewamy po 10 kropli roztworu nr 3 - jeden dla soli kobaltu i jeden dla soli chromu. Dla każdej soli z osobna wybieramy do dalszych pomiarów tą diodę, dla której wartość zmierzonej transmitancji w spektrometrze Spektra TM jest najniższa (czyli absorbancja jest najwyższa!). Pomiaru transmitancji należy dokonać względem wody dejonizowanej jako próbki odniesienia.
3. Pomiar transmitancji roztworów soli kobaltu i chromu sporządzonych w pkt. 1
Dla każdego roztworu soli kobaltu (patrz: 5 roztworów z tabeli w pkt. 1, po 10 kropli roztworu) wykonać po trzy pomiary transmitancji używając obu diod (każdej z osobna) wybranych w punkcie 2 (otrzymujemy 6 wyników pomiarowych dla każdego roztworu). To samo wykonać dla roztworów soli chromu. Otrzymane wartości transmitancji zamieścić w tabeli, a następnie przeliczyć na absorbancję (zgodnie ze wzorem A = -log(T/100) lub odczytać wartości z tabeli w załącznikach). Pomiaru transmitancji należy dokonać względem wody dejonizowanej jako próbki odniesienia.
Wyniki pomiaru transmitancji
Nr roztworu |
T (roztwór soli Co2+) |
T (roztwór soli Cr3+) |
dioda1 |
dioda2 |
dioda1 |
dioda2 |
1 |
|
|
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
3 |
|
|
|
|
|
|
|
|
|
|
|
|
4 |
|
|
|
|
|
|
|
|
|
|
|
|
5 |
|
|
|
|
|
|
|
|
|
|
|
|
dioda1 – dioda wybrana dla roztworu soli kobaltu – dioda koloru ..........
dioda2 – dioda wybrana dla roztworu soli chromu – dioda koloru ..........
Wartości absorbancji (po przeliczeniu z wartości transmitancji)
Nr roztworu |
T (roztwór soli Co2+) |
T (roztwór soli Cr3+) |
dioda1 |
dioda2 |
dioda1 |
dioda2 |
1 |
|
|
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
3 |
|
|
|
|
|
|
|
|
|
|
|
|
4 |
|
|
|
|
|
|
|
|
|
|
|
|
5 |
|
|
|
|
|
|
|
|
|
|
|
|
4. Sporządzenie krzywych wzorcowych
Poniższe tabele należy uzupełnić w następujący sposób. Dla 5 roztworów kobaltu wpisać wartości wcześniej obliczonych stężeń, a następnie podać uśrednione wartości absorbancji z trzech pomiarów (wyznaczone dla diody 1 i diody 2). Na podstawie utworzonych tabel sporządzić wykresy krzywych wzorcowych, tzn. zależności absorbancji dla danej diody od stężenia roztworu (A = f(c). Do sporządzenia wykresów wykorzystać program Microsoft Excel.
Tabela uśrednionych wartości absorbancji dla roztworu soli kobaltu
Nr roztworu |
c [mol dm-3] |
A (
średnie ) |
dioda1 |
dioda2 |
1 |
|
|
|
2 |
|
|
|
3 |
|
|
|
4 |
|
|
|
5 |
|
|
|
Tabela uśrednionych wartości absorbancji dla roztworu soli chromu
Nr roztworu |
c [mol dm-3] |
A ( średnie ) |
dioda1 |
dioda2 |
1 |
|
|
|
2 |
|
|
|
3 |
|
|
|
4 |
|
|
|
5 |
|
|
|
5. Sporządzenie roztworów dwuskładnikowych oraz pomiar ich absorbancji
W kolbach miarowych o pojemności 25cm3 sporządzamy roztwory zgodnie z poniższą tabelą (każdy roztwór to mieszanina soli kobaltu i chromu). Dla każdego roztworu (10 kropli) wykonać po pięć pomiarów transmitancji (dla każdej diody osobno) i tak jak w punkcie 4 przeliczyć ją na absorbancję. Przeliczone wartości absorbancji uśrednić. Pomiaru transmitancji należy dokonać względem wody dejonizowanej jako próbki odniesienia.
Roztwory podstawowe |
Roztwór A |
Roztwór B |
V [cm3] |
V [cm3] |
Co(NO3)2· 6 H2O 65 [g dm-3] |
0,5 |
4,0 |
Cr(NO3)3 · 9 H2O 120 [g dm-3] |
2,5 |
10 |
H2O |
22 |
11 |
Wyniki pomiarów uzyskane przy wykorzystaniu diody1
Nr pomiaru |
roztwór A |
roztwór B |
T |
A |
A (średnie) |
T |
A |
A (średnie) |
1 |
|
|
|
|
|
|
2 |
|
|
|
|
3 |
|
|
|
|
4 |
|
|
|
|
5 |
|
|
|
|
Wyniki pomiarów uzyskane przy wykorzystaniu diody2
Nr pomiaru |
roztwór A |
roztwór B |
T |
A |
A (średnie) |
T |
A |
A (średnie) |
1 |
|
|
|
|
|
|
2 |
|
|
|
|
3 |
|
|
|
|
4 |
|
|
|
|
5 |
|
|
|
|
6. Obliczenie stężeń jonów Co2+ i Cr3+ w roztworach A i B.
W celu wykonania obliczeń należy odczytać współczynniki kierunkowe a z krzywych wzorcowych A = a·c
aCo2+, dioda 1=
aCo2+, dioda 2=
aCr3+, dioda 1=
aCr3+, dioda 2=
Dla każdego roztworu obliczamy zgodnie z poniższym układem równań wartości stężeń jonów Co2+ i C3+ (nauczyciel objaśnia w jaki sposób został otrzymany poniższy układ równań).
A dioda 1= aCo2+, dioda 1 · cCo2+ + aCr3+, dioda 1 · cCr3+
A dioda 2 = aCo2+, dioda 2· cCo2+ + aCr3+, dioda 2 · cCr3+
7. Porównanie otrzymanych wyników z wartością oczekiwaną
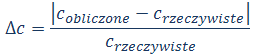
Wyznaczyć wartość błędu względnego (Δc) dla wyznaczonych stężeń jonów Co2+ i Cr2+ (w punkcie 6), zgodnie z poniższym równaniem:
Stężenia rzeczywiste należy obliczyć na podstawie składów roztworu A i B zamieszczonych w tabeli w punkcie 5. Wyznaczone stężenia w jednostkach g dm-3 przeliczamy na jednostkę mol dm-3 dzieląc uzyskane wyniki przez masę molową odpowiedniej substancji (sól kobaltu M1=............,
sól chromu M2=............).
Obliczenie stężeń jest analogiczne jak w punkcie 1.
8. Wyznaczenie stężenia jonów Co2+ i Cr3+ w nieznanej próbce X.
Próbkę o nieznanej zawartości jonów Co2+ i Cr3+ należy poddać analizie zgodnie z punktem 5 i 6.
Nr pomiaru |
próbka X (dioda1) |
próbka X (dioda2) |
T |
A |
A (średnie) |
T |
A |
A (średnie) |
1 |
|
|
|
|
|
|
2 |
|
|
|
|
3 |
|
|
|
|
4 |
|
|
|
|
5 |
|
|
|
|
Opracowanie: Tomasz Chmiel, Tomasz Dymerski, Technikum Przemysłu Spożywczego i Chemicznego w Gdańsku
Redakcja i korekta: Marek Kwiatkowski, Wydział Chemii Uniwersytetu Gdańskiego
|