|

PORÓWNANIE EFEKTYWNOŚCI RÓŻNYCH METOD USUWANIA JONÓW MIEDZI ZE ŚCIEKÓW
Ścieki o dużej zawartości jonów miedzi powstają podczas wielu operacji przemysłowych: uzyskiwania metalicznej miedzi z rud miedzi, wyciągania drutu miedzianego, polerowania miedzi, wytwarzania obwodów drukowanych, pokrywania powłokami galwanicznymi, produkcji farb i środków ochrony drewna, drukowania, itp. Jony miedzi są bardzo toksyczne dla mikroorganizmów wodnych, dlatego należy je usunąć z zanieczyszczonej wody przed wprowadzeniem jej do środowiska. Wysokie stężenie jonów miedzi w wodzie może być również niebezpieczne dla człowieka, gdyż miedź ulega bioakumulacji w rybach i innych organizmach wyższych wchodzących w skład łańcucha pokarmowego.
Tabela 1: Rudy miedzi (źródło: Wikipedia)
Malachit
- CuCO3.Cu(OH)2 |
Chalkopiryt
- CuFeS2 |
|
|
Jony miedzi można usunąć z wody za pomocą wytrącania lub redukcji. W obu przypadkach powstają produkty stałe, które po odfiltrowaniu i ewentualnym skorygowaniu pH trafiają na składowiska odpadów przemysłowych lub poddawane są recyklingowi.
Twoje zadanie
Laboratoria szkolne stanowią również źródło wody zanieczyszczonej jonami miedzi, gdyż wodny roztwór siarczanu(VI) miedzi(II) jest często wykorzystywany jako odczynnik do wielu celów. Przed wylaniem do zlewu, woda ta powinna być w odpowiedni sposób oczyszczona. Twoim zadaniem jest znalezienie najbardziej efektywnej metody usuwania jonów miedzi(II) z zanieczyszczonej wody.
Odczynniki służące do strącania i redukcji jonów miedzi zostały przedstawione na Rys. 1.
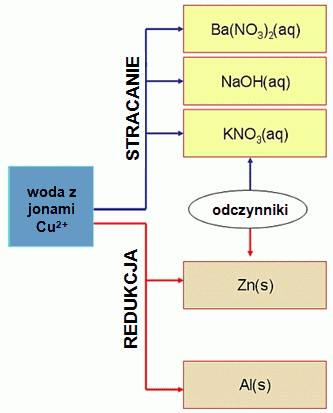
Rysunek 1:Odczynniki służące do usuwania jonów miedzi
Bezpieczeństwo
Używaj odzieży ochronnej: fartucha laboratoryjnego, okularów ochronnych i rękawic ochronnych.
Ba(NO3)2– może powodować podrażnienie skóry i oczu; jest niepalny i nie reaguje z wodą; pod wpływem ognia wydziela trujące gazowe tlenki azotu.
NaOH – żrący i trujący w przypadku spożycia; kontakt ze skórą wywołuje oparzenia, dłuższy kontakt może prowadzić do stanów zapalnych skóry; jest niepalny, w wodzie dysocjuje na jony sodu i jony wodorotlenkowe; roztwory wodne są mocnymi zasadami.
R 35, S 26, 37/39 45
KNO3 – ma właściwości utleniające; powoduje podrażnienia skóry i oczu; jest niepalny, nie reaguje z wodą; pod wpływem ognia wydziela trujące gazowe tlenki azotu.
Sprzęt i odczynniki
- Woda zanieczyszczona jonami miedzi (dostarczona przez nauczyciela)
- CuSO4 (aq) – 0,5 mol dm-3
- Ba(NO3)2(aq) – 1 mol dm-3
- NaOH(aq) – 1 mol dm-3
- KNO3(aq) – 1 mol dm-3
- Folia aluminiowa (Al)
- Cynk granulowany (Zn)
- Blistry
- Woda dejonizowana
- Próbówki i stojaki
- Plastikowe buteleczki zaopatrzone we wkraplacze
- Bagietki szklane
- Lejki
- Sączki papierowe
- Spektrometr SpektraTM
Sposób postępowania
1. Przygotowanie krzywej kalibracyjnej.
Napełnij zagłębienia blistra wzorcowym roztworem jonów Cu2+ zgodnie ze wskazówkami w Tabeli 2.
Tabela 2: Przygotowanie krzywej kalibracyjnej
Roztwory |
1. |
2. |
3. |
4. |
5. |
6. |
7. |
8. |
9. |
Próbka odnies. |
CuSO4(aq)
krople
|
1
|
2 |
3 |
4 |
5 |
6
|
7 |
8 |
9 |
|
Woda dejoniz., krople |
8 |
7 |
6 |
5 |
4 |
3 |
2 |
1 |
0 |
9 |
c [mmol
dm-3]
|
0,056 |
0,111 |
0,167 |
0,222 |
0,278 |
0,333 |
0,389 |
0,444 |
0,500 |
0,0 |
T
|
|
|
|
|
|
|
|
|
|
|
A
|
|
|
|
|
|
|
|
|
|
|
Zmierz transmitancję roztworów względem próbki odniesienia (woda dejonizowana), używając diody emitującej czerwone światło. Zapisz wyniki w Tabeli 2.
2. Przy pomocy oprogramowania Excel oblicz wartość absorbancji i wygeneruj wykres krzywej kalibracyjnej. Wyznacz równanie otrzymanej prostej.

Wykres 1: Krzywa kalibracyjna
3. Wstaw sześć probówek do stojaka i dodaj odczynników, zgodnie ze wskazówkami w Tabeli 3.
Tabela 3: Przygotowanie mieszanin reakcyjnych
Probówka / odczynnik
|
1.
Ba(NO3)2(aq) |
2.
NaOH(aq)
|
3.
KNO3(aq)
|
4.
Zn(s)
|
5.
Al(s)
|
6.
Nieprzereago-wany roztwór jonów miedzi
|
objętość/masa [cm3] lub [g] |
4 |
4 |
4 |
2g* |
0,5 g* |
|
Woda [ml] |
0 |
0 |
0 |
4 |
4 |
4 |
Cu2+(próbka) [ml] |
6 |
6 |
6 |
6 |
6 |
6 |
*Do reakcji użyj drobnych granulek cynku i zgniecionej folii aluminiowej, aby zapewnić możliwe dużą powierzchnię reakcji.
4. Wytrząśnij mieszaniny reakcyjne i odczekaj 15 – 20 minut do oddzielenia się przeźroczystej warstwy roztworu. Przesącz zawartość probówek nr 1 i 2, oraz w razie potrzeby probówki nr 4 do plastikowych buteleczek z zakraplaczami. Zawartość pozostałych probówek przenieś bezpośrednio do buteleczek.
5. Odmierz po dziewięć kropli uzyskanych roztworów do zagłębień blistra, a do kolejnego zagłębienia dodaj dziewięć kropli nieprzereagowanej próbki. Jako próbki odniesienia użyj wody dejonizowanej. Zmierz transmitancję i przelicz na wartości absorbancji. Określ stężenie jonów miedzi w każdym roztworze za pomocą krzywej kalibracyjnej lub równania prostej, Tabela 4.
Tabela 4: Wyniki po procesie oczyszczania
|
Strącanie |
Redukcja |
Nieprzereag. |
Roztwór po oczyszczaniu |
Ba(NO3)2(aq) |
NaOH(aq) |
KNO3(aq) |
Zn(s) |
Al(s) |
Cu2+(waste) |
T |
|
|
|
|
|
|
A |
|
|
|
|
|
|
c [mmol
dm-3] |
|
|
|
|
|
|
6. Przedyskutuj, która z metod oczyszczania jest najbardziej efektywna:
Pytania i problemy kontrolne
1. Napisz równania chemiczne wszystkich reakcji zachodzących podczas usuwania jonów miedzi. Do tego celu wykorzystaj wartości rozpuszczalności w Tabeli 5 oraz wartości potencjałów elektrochemicznych w Tabeli 6.
Tabela 5: Rozpuszczalność w wodzie
Związek |
Rozpuszczalność [g dm-3] |
Ba(NO3)2 |
79 (20°C) |
BaSO4 |
nierozpuszczalny
|
CuSO4.5H2O |
316 (20°C) |
Cu(NO3)2 |
rozpuszczalny
|
NaOH |
1100 |
Na2SO4 |
2680 |
Cu(OH)2 |
0,0025 (25°C) |
KNO3 |
357 |
K2SO4 |
11 (20°C) |
Al2(SO4)3 |
870 |
ZnSO4 |
rozpuszczalny
|
Tabela 6: Potencjały elektrochemiczne
Metal/cation |
E° (volts) |
Lit/Li+ |
-3,03 |
Potas/K+ |
-2,92 |
Wapń/Ca2+ |
-2,87 |
Sód/Na+ |
-2,71 |
Magnez/Mg2+ |
-2,37 |
Glin/Al3+
|
-1,66 |
Cynk/Zn2+ |
-0,76 |
Żelazo/Fe2+ |
-0,44 |
Ołów/Pb2+ |
-0,13 |
Woda/H+ |
0 |
Miedź/Cu2+ |
+0,34 |
Srebro/Ag+ |
+0,80 |
Złoto/Au3+ |
+1,50 |
2. Która z metod usuwania jonów miedzi była najskuteczniejsza i dlaczego?
3. Przedyskutuj pozytywne i negatywne aspekty tej metody.
4. Czy otrzymaną krzywą kalibracyjną, wykorzystaną do wyznaczenia stężenia jonów miedzi w oczyszczonych próbkach, można zastosować do każdej innej wody zanieczyszczonej jonami miedzi, niezależnie od jej pochodzenia? Wyjaśnij.
5. Zaproponuj jeszcze inne metody, za pomocą których można by było usuwać jony miedzi z zanieczyszczonej wody.
Opracowanie i optymalizacja: Margareta Vrtačnik, Vida Mesec, Uniwersytet w Lublanie (Słowenia), NTF-KII. |