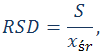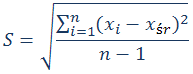Procedura1. Przygotowanie roztworów wzorcowych W kolbkach miarowych o pojemności 50 cm3 sporządzamy roztwory o odpowiednich stężeniach, poprzez zmieszanie odpowiedniej ilości roztworu podstawowego z 5 cm3 roztworu tiocyjanianu amonu NH4SCN (20%) i 2 cm3 roztworu kwasu azotowego HNO3 (2 mol dm-3), a następnie dopełnienie wodą dejonizowaną do kreski (proporcje poszczególnych składników zawarte w poniższej tabeli). Roztwór podstawowy żelaza – wodny roztwór siarczanu(VI) amonu żelaza(III) dodekahydratu (ałunu żelazowo-amonowego) Fe(NH4)(SO4)2 · 12 H2O o stężeniu 0,01 mg Fe cm-3.
2. Dobór odpowiedniej diody Aby dobrać odpowiednią diodę (długość fali promieniowania widzialnego) do zagłębienia blistra wprowadzamy 10 kropli roztworu sporządzonego z roztworu o stężeniu 0,003 mg Fe cm-3. Następnie dokonujemy pomiaru transmitancji dla każdej z diody z osobna. Pomiary wykonujemy względem wody dejonizowanej (nalewamy kilka kropel do innego zagłębienia blistra). Do dalszych pomiarów wybieramy tą diodę, dla której wartość zmierzonej transmitancji jest najniższa (czyli absorbancja jest najwyższa!). 3. Pomiar transmitancji roztworów żelaza sporządzonych w pkt. 1 Dla każdego roztworu jonów żelaza(III) (pięć roztworów z tabeli w pkt. 1, po 10 kropli w zagłębieniu blistra) wykonać po trzy pomiary transmitancji używając diody dobranej w pkt. 2. Otrzymane wartości transmitancji zamieścić w tabeli, a następnie przeliczyć na wartości absorbancji (zgodnie ze wzorem A = -log(T/100) lub odczytać wartości z tabeli w załącznikach). Obliczyć wartości średnie absorbancji dla trzech pomiarów. Pomiary transmitancji wykonać względem wody dejonizowanej jako próbki odniesienia. Wyniki pomiarów
4. Sporządzenie krzywej wzorcowej Na podstawie danych w tabeli z pkt. 3 (tzn. wartości stężeń roztworów i wartości średnich absorbancji) sporządzić wykres krzywej wzorcowej, tzn. zależności absorbancji od stężenia roztworu (A = f(c). Wykres sporządzić przy użyciu programu Microsoft Excel. 5. Wyznaczenie stężenia żelaza(III) w próbce wody gruntowej Odmierzyć 25 cm3 wody gruntowej do kolbki miarowej o pojemności 50 cm3, dodać 5 cm3 roztworu NH4SCN (20%) i 2 cm3 roztworu HNO3 (2 mol dm-3), a następnie uzupełnić wodą dejonizowaną do kreski. Dla tak otrzymanego roztworu wykonać pięć pomiarów transmitancji używając diody dobranej w pkt. 2 (10 kropli w zagłębieniu blistra). Otrzymane wartości transmitancji zamieścić w tabeli, a następnie przeliczyć na absorbancję (zgodnie ze wzorem A = -log(T/100) lub odczytać wartości z tabeli w załącznikach). Przeliczone wartości absorbancji uśrednić.
Następnie obliczyć stężenie jonów żelaza(III) w próbce wody gruntowej, na podstawie równania krzywej, w następujący sposób: c = 2 · A/a a –
współczynnik kierunkowy krzywej wzorcowej 6. Wyznaczenie powtarzalności pomiarów Obliczyć względne odchylenie standardowe (RSD) zgodnie z poniższymi wzorami.
RSD –
względne odchylenie standardowe (relative standard deviation) Literatura
Opracowanie: Tomasz Chmiel, Tomasz Dymerski, Technikum Przemysłu Spożywczego i Chemicznego w Gdańsku Redakcja i korekta: Marek Kwiatkowski, Wydział Chemii Uniwersytetu Gdańskiego |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||