|

IZOTERMY ADSORPCJI
Badania nad zastosowaniem spektrometru Spektra TMw nauczaniu przedmiotów przyrodniczych w szkołach ponadgimnazjalnych
Tom Lawless
Chemistry Department
Weymouth College
Dorset DT4 7LQ
Podstawy
We wrześniu 2004, Weymouth College, jako jeden z czterech instytucji w Wielkiej Brytanii, został wybrany do przetestowania działania nowatorskiego, uproszczonego spektrometru o nazwie SpektraTM. Konstrukcja tego instrumentu opiera się na zastosowaniu trzech diod elektroluminescencyjnych jako źródła światła oraz blistrów z tworzywa sztucznego z dziesięcioma zagłębieniami, które służą jako naczynia pomiarowe (pojemność zagłębienia ~350 µl).
Spektrometr został wprowadzony do szkół w ramach programu "Leonardo da Vinci", sponsorowanego przez Unię Europejską. W programie tym wzięły udział instytucje akademickie z trzech krajów: Anglii, Portugalii i Słowenii, przy czym brytyjskim partnerem w projekcie był Hull University (koordynator projektu prof. Alan Townshend). Ocena odbyła się na podstawie wykorzystania spektrometru w lekcjach chemii dla uczniów szkół ponadgimnazjalnych (wiek 16 – 19 lat) w warunkach typowych dla prac laboratoryjnych. Ocena trwała przez jeden rok akademicki a jej wyniki zostały ogłoszone na konferencji "National Teachers Conference" w University of Hull w czerwcu 2005.
Wstęp
Kolory otaczają nas zewsząd, co może stanowić znakomity punkt wyjścia do zaangażowania uczniów w dyskusję nad podstawowymi zasadami nauk przyrodniczych, takich jak chemia czy fizyka. Spektroskopia, a w szczególności spektroskopia w świetle widzialnym, umożliwia uczniom zrozumienie jak powstaje kolor i jak zastosować spektroskopię do oznaczeń ilościowych barwnych składników. Poniżej przedstawiono, w jaki sposób spektroskopia w świetle widzialnym została wykorzystana w nauczaniu chemii w Weymouth College.
Zastosowania dla uczniów szkół ponadgimnazjalnych
Na etapie szkoły ponadgimnazjalnej, w skład treści programowych wchodzą między innymi takie zagadnienia jak: barwa (kolor), przejścia elektronowe, teoria kwantowa, barwniki, tkaniny, adsorpcja na węglu aktywnym, krzywe kalibracyjne, zagadnienia równowagowe, proces rozpuszczania i wiele innych, związanych zarówno ze związkami nieorganicznymi, jak i organicznymi. Projekt stanowił dobrą okazję do zaangażowania niektórych uczniów na poziomie A2 i AVCE w ramach ich “Individual Investigations”, co zaowocowało szeregiem interesujących i wartościowych doświadczeń.
Badania przeprowadzone przez uczniów
Badania te koncentrowały się wokół opracowywania izoterm adsorpcji dla barwników adsorbowanych z roztworu wodnego na węglu aktywnym. Do doświadczeń wybrano dwa barwniki o charakterze anionowym: ACID BLUE 45 i BRILLIANT CROSEIN MOO (czerwony), ponieważ absorbowały w przeciwnych krańcach widma światła widzialnego i były porównywalne do siebie w roztworze. Doświadczenia przeprowadzano indywidualnie dla poszczególnych barwników oraz w mieszanie barwników (badania kompetytywne).
Węgiel aktywny: Darco G60
Barwniki: Acid Blue 45, Brilliant Crosein MOO
Temperatura: pokojowa
Czas ekwilibracji (osiągnięcia stanu równowagi): minimum 48
Układy równowagowe: 40 cm3 roztworu barwnika (stężenia w zakresie 0.5 – 0.004 % m/v) + 0.30 g węgla aktywnego umieszczone w butelkach szklanych o pojemności 100 cm3 zamykanych nakrętką.
(Dla mieszanin stosowano stosunek barwników 1:1 a stężenia utrzymywano na tym samym poziomie jak powyżej).
Po upłynięciu czasu ekwilibracji, próbki sączono a roztwory badano w spektrometrze (jeżeli to było konieczne, próbki rozcieńczano przed pomiarem).
Krzywe kalibracyjne
Przygotowano serie roztworów, aby uzyskać odpowiedni zakres pomiaru dla roztworów barwników. Uzyskane wartości przeliczono na wartości absorbancji. Uzyskano następujące krzywe:
Rys. 1 Krzywe kalibracyjne dla Acid Blue (350 µl w zagłębieniach blistra)
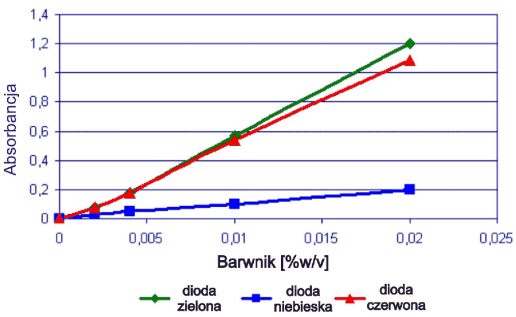
Rys. 2 Krzywe kalibracyjne dla Brilliant Crosein MOO (350 µl w zagłębieniach blistra)
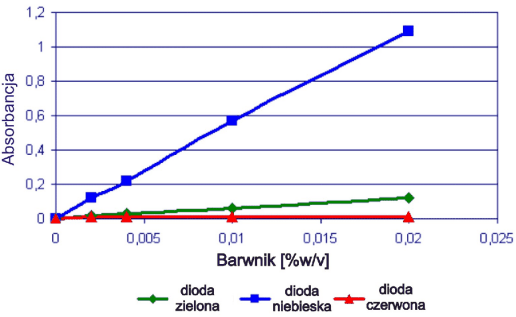
Rys. 3. Krzywe kalibracyjne dla mieszanego układu barwników (1:1) (350 µl w zagłębieniach blistra)
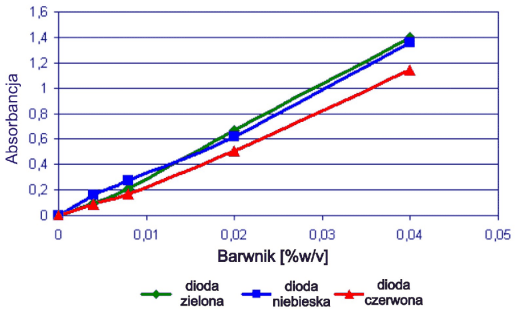
Dla wszystkich układów stwierdzono zależności liniowe, chociaż jednoznaczne przypisanie wartości absorbancji poszczególnym diodom było problematyczne bez dodatkowego potwierdzenia inną metodą. Dlatego wszystkie układy poddano również badaniom za pomocą spektrometrii skaningowej w świetle widzialnym.
Widma skaningowe w świetle widzialnym.
Widma przedstawiono na Rys. 4. Długości fali światła emitowanego przez trzy diody w spektrometrze SpektraTM wynoszą 430, 565 i 625 nm, a analiza poniższych widm pozwala na wyjaśnienie jak należy wybrać absorbancję przy wybranym źródle światła. Barwnik niebieski absorbuje w mniej więcej równym stopniu światło emitowane przez czerwoną i zieloną diodę, a światło niebieskiej diody absorbuje w znacznie mniejszym stopniu (absorpcja ta jednak musi być uwzględniona podczas pomiarów dla układu złożonego z dwóch barwników).
Rys. 4. Widma skaningowe dla poszczególnych barwników
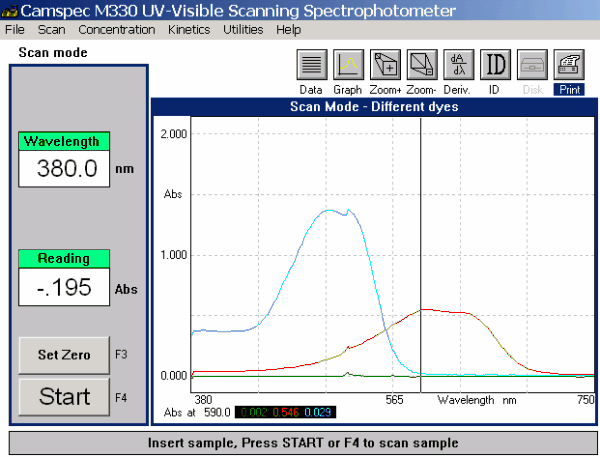
Barwnik czerwony wykazuje silną absorpcję światła emitowanego przez niebieską diodę. Absorpcja światła zielonej diody jest pomijalnie mała, natomiast barwnik praktycznie nie absorbuje światła emitowanego przez czerwoną diodę. Te obserwacje są w pełni zgodne z wynikami otrzymanymi za pomocą SpektraTM i wskazują na pomijalnie małą wartość absorpcji czerwonego światła przez barwnik czerwony (przy użyciu światła emitowanego przez czerwoną diodę można ilościowo oznaczyć zawartość niebieskiego barwnika w obecności czerwonego barwnika w mieszaninie).
Widmo skaningowe układu zawierającego dwa barwniki przedstawiono na Rys. 5.
Rys. 5. Widmo skaningowe dla układu zawierającego oba barwniki
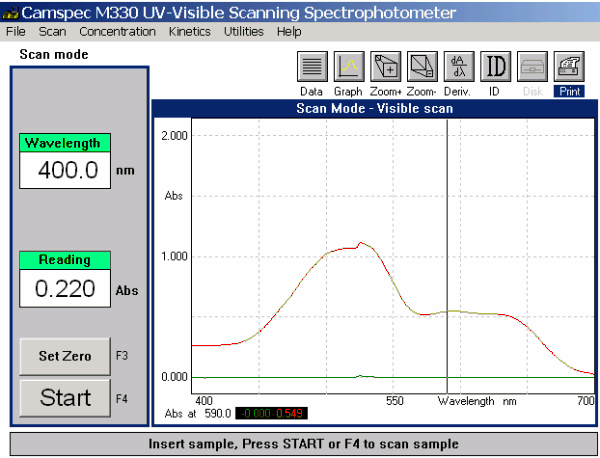
Widmo to jest po prostu sumą widm indywidualnych barwników.
Porównanie danych ze spektrometru skaningowego z danymi otrzymanymi przy pomocy spektrometru SpektraTM, pozwoliły na zaproponowanie następującego sposobu oznaczania barwników w mieszaninie:
- Oznaczenie barwnika niebieskiego: zmierzyć absorbancję światła emitowanego przez czerwoną diodę, nie wymaga korekcji związanej absorpcją czerwonego światła przez czerwony barwnik
- Oznaczenie barwnika czerwonego: zmierzyć absorbancję światła emitowanego przez niebieską diodę, wymaga korekcji związanej z pewną absorpcją światła niebieskiego przez barwnik niebieski.
Absorpcja światła niebieskiego przez barwnik niebieski będzie zależała od jego stężenia w roztworze.
Oznaczmy wartość absorbancji dla światła emitowanego przez czerwoną diodę jako X. Wartość ta będzie proporcjonalna do stężenia barwnika niebieskiego.
Ponieważ jednak barwnik niebieski absorbuje również światło emitowane przez niebieską diodę na poziomie ok. 0,2 X, wartość tę należy odjąć od wartości absorbancji zmierzonej za pomocą światła emitowanego przez niebieską diodę, aby prawidłowo wyznaczyć stężenie barwnika czerwonego.
Zatem jeżeli oznaczymy wartość absorbancji dla światła emitowanego przez niebieską diodę jako Y, to stężenie barwnika czerwonego w roztworze będzie wynosić Y – 0,2 X
Tym sposobem można było wyznaczyć profile adsorpcji barwników na węglu aktywnym w układach zawierających oba barwniki.
Izotermy adsorpcji
Profile adsorpcji dla poszczególnych barwników oraz dla układów mieszanych wyznaczono stosując procedury opisane powyżej.
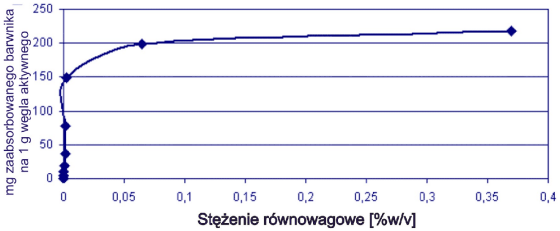
Rys. 6. Izoterma adsorpcji dla barwnika Brilliant Crosein MOO
Rys. 7. Izoterma adsorpcji dla barwnika Acid Blue 45
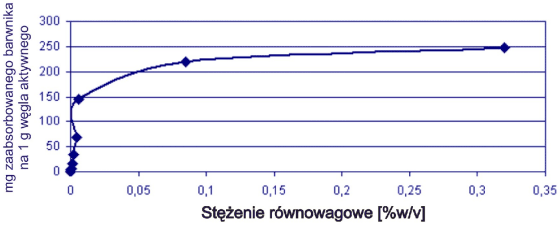
Obie krzywe miały typowy przebieg, zgodny z profilem Langmuira.
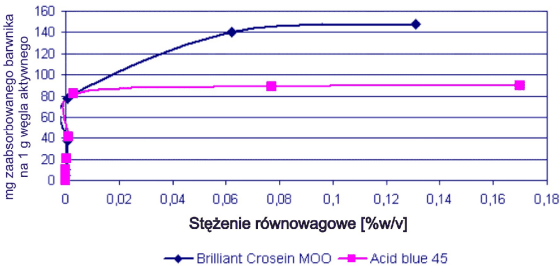
W układzie mieszanym, czerwony barwnik wykazywał większą tendencję do adsorpcji na węglu aktywnym niż barwnik niebieski.
Rys. 8. Profile adsorpcji dla układu zawierającego oba barwniki
Dyskusja i wnioski
Użycie spektrometru SpektraTM pozwoliło na wyznaczenie krzywych kalibracyjnych, które można było wykorzystać do określenia profili absorpcji barwników, zarówno indywidualnych, jak również w mieszaninie. Użycie spektrometru skaningowego pozwoliło na lepsze zrozumienie sposobu opracowywania wyników pomiarów. Ćwiczenie okazało się interesujące dla uczniów, obejmując wiele różnorodnych treści wchodzących w zakres ich programów nauczania.
Wady i zalety stosowania spektrometru SpektraTM przedstawiono poniżej:
Zalety
Obsługa przyrządu oraz jego kalibracja jest wyjątkowo prosta. Łatwo również dokonuje się odczytu mierzonej wartości. Do pomiarów używa się próbek o bardzo małej objętości, co wydatnie zmniejsza koszt użytkowania, zagrożenia związane z pracą w laboratorium oraz ogranicza ilość odpadów. Użycie blistra pozwala na pomiar 10 próbek, również względem czasu – np. za pomocą przyrządu można badać kinetykę enzymatycznej hydrolizy skrobi przy różnych wartościach pH.
Wady
Odmierzanie roztworów za pomocą kropli nie jest ilościowe. Blister nie nadaje się do pracy z wieloma rozpuszczalnikami. Istnieje ryzyko przypadkowego rozlania próbek w komorze pomiarowej, jednak najważniejsze części przyrządu są zabezpieczone przed zanieczyszczeniem. Instrukcja obsługi przyrządu wymaga więcej wyjaśnień i ilustracji (to już zostało wykonane). Objętość kropli zależy od napięcia powierzchniowego, co może powodować błędy.
|