Reakcja z tiocyjanianami jest historycznie najstarszą metodą oznaczania jonów żelaza(III) w roztworze. Metoda ta nie jest szczególnie czuła, czy też selektywna. Tym niemniej została wybrana dla celów tej analizy ze względu na powszechną dostępność odczynników. APARATURA I ODCZYNNIKI
ZAGROŻENIA
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Kwas solny HCl jest substancją żrącą i trującą, powoduje poważne podrażnienia górnych dróg oddechowych i jest szkodliwy jeśli zostanie wchłonięty przez skórę. Należy unikać wdychania i kontaktu ze skórą. |
|
|
Tiocyjanian potasu KSCN . |
|
|
Chlorek żelaza(III), heksahydrat FeCl3 . 6 H2O może wywoływać poważne oparzenia układu oddechowego. Wywołuje również oparzenia skóry, w przypadku kontaktu z kwasami wydziela trujące gazy. |
PROCEDURA
Przygotowanie próbki przyprawy:
- Zważ suchy i czysty tygiel.
- Utrzyj równomiernie próbkę przyprawy.
- Odważ 1 g sproszkowanej przyprawy w tyglu.
- Ogrzewaj tygiel z próbką w płomieniu palnika. Gdy zaobserwujesz zmniejszenie się objętości próbki, podpal zawartość tygla. Po spaleniu próbki ogrzewaj dalej popiół, aż zawartość tygla będzie stanowił jasnoszary popiół bez ciemnych cząstek (dla bazylii czas ogrzewania wynosi półtora godziny, inne próbki wymagają więcej czasu).
- Po zakończeniu prażenia ochłodź tygiel do temperatury pokojowej.
- Zważ tygiel z próbką popiołu.
- Dodaj 5 ml 2 M HCl do tygla.
- Odparuj zawartość tygla na łaźni wodnej.
- Ochłodź tygiel i dodaj 3 ml wody dejonizowanej, 5 ml 2 M HCl i 5 ml 0,1 M KSCN.
- Przesącz próbkę przez sączek ilościowy. Odrzuć pierwszą 1/3 przesączu i zbierz pozostałą część w suchej kolbce szklanej z korkiem.
Przygotowanie roztworu do rozcieńczania oraz roztworu wyjściowego tiocyjanianowego kompleksu żelaza(III):
- Przygotuj roztwór do rozcieńczania przez zmieszanie ze sobą w suchej szklanej kolbce 3 ml wody dejonizowanej, 5 ml 0,1 M KSCN i 5 ml 2 M HCl.
- Przygotuj rozwór wyjściowy tiocyjanianowego kompleksu żelaza przez zmieszanie ze sobą w suchej szklanej kolbce 0,5 ml 0,05 M FeCl3, 2,5 ml wody dejonizowanej, 5 ml 0,1 M KSCN i 5 ml 2 M HCl.
Pomiary spektrofotometryczne
Przygotuj roztwór odniesienia, próbkę(i) i serię roztworów do kalibracji bezpośrednio w zagłębieniach blistra, zgodnie ze wskazówkami w tabeli:
|
|
γ(Fe3+) |
Roztwór wyjściowy kompleksu |
Roztwór |
Roztwór próbki |
|
Roztwór odniesienia |
- |
0 |
450 |
- |
|
Próbka |
- |
- |
- |
450 |
|
Roztwór kalibr. 1 |
12,1 |
50 |
400 |
- |
|
Roztwór kalibr. 2 |
24,3 |
100 |
350 |
- |
|
Roztwór kalibr. 3 |
36,4 |
150 |
300 |
- |
|
Roztwór kalibr. 4 |
48,6 |
200 |
250 |
- |
|
Roztwór kalibr. 5 |
60,7 |
250 |
200 |
- |
|
Roztwór kalibr. 6 |
72,9 |
300 |
150 |
- |
|
Roztwór kalibr. 7 |
85,0 |
350 |
100 |
- |
|
Roztwór kalibr. 8 |
97,2 |
400 |
50 |
- |
|
Roztwór kalibr. 9 |
109,3 |
450 |
0 |
- |
Wstaw blister do komory pomiarowej spektrometru SpektraTM, umieść roztwór odniesienia w miejscu pomiaru. Do pomiarów używaj diody niebieskiej przy maksymalnym natężeniu świecenia i ustaw transmitancję roztworu odniesienia na 100,0. Zmierz transmitancję próbki(ek) i roztworów kalibracyjnych. Zapisz wyniki w poniższej tabeli, oblicz wartości absorbancji i sporządź krzywą kalibracyjną.
|
|
|
Roztwory kalibracyjne |
||||||||
|
|
Próbka |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
γ(Fe3+) |
? |
12,1 |
24,3 |
36,4 |
48,6 |
60,7 |
72,9 |
85,0 |
97,2 |
109,3 |
T |
|
|
|
|
|
|
|
|
|
|
A |
|
|
|
|
|
|
|
|
|
|
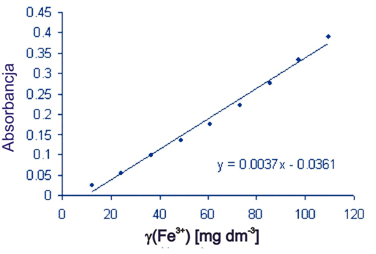
Oblicz stężenie żelaza w próbce za pomocą równania liniowego wyznaczonego z krzywej kalibracyjnej.
Uwaga
Jeśli absorbancja próbki przekroczy wartość absorbancji najbardziej stężonego roztworu kalibracyjnego, próbki nie należy rozcieńczać wodą. Dodanie wody spowoduje przesunięcie równowagi chemicznej i doprowadzi do błędnych wyników. Próbkę należy rozcieńczyć wyłącznie roztworem do rozcieńczeń. Rozcieńczenie musi być uwzględnione podczas obliczania zawartości żelaza w próbce.
Zawartość żelaza obliczamy wówczas w następujący sposób:
|
m(Fe3+) = |
γ(Fe3+) · 0,013 dm3 · 100 g |
|
mpróbki |
Przykład
Do analizy użyto 1,0041 g suszonej bazylii. Transmitancja próbki zmierzona względem roztworu odniesienia za pomocą niebieskiej diody wyniosła 77,5%.
A = -log(77,5/100) = 0,1107
0,1107 = 0,0037 x – 0,0361
γ(Fe3+) = x = 39,67 mg dm-3
|
m(Fe3+) = |
39,67 mg · 0,013 dm3· 100 g |
= 51,4 mg |
|
dm3· 1,0041 g |
Zawartość żelaza w suszonej bazylii wynosi 51,4 mg na 100 g przyprawy.
Opracowanie: Margareta Vrtačnik*, Vida Mesec*, Nataša Gros** i Domen Klančar**
*Universytet w Lublanie, Wydział Nauk Przyrodniczych i Inżynierii
**Uniwersytet w Lublanie, Wydział Chemii i Technologii Chemicznej
