|

2. WPŁYW TEMPERATURY NA SZYBKOŚĆ
HYDROLIZY ASPIRYNY
2.1 Cel
Sporządzenie krzywej kalibracyjnej i zbadanie szybkości hydrolizy roztworu Aspirin ® w temperaturze pokojowej i w podwyższonej temperaturze. Porównanie i dyskusja wyników.
2.2 Wprowadzenie
Aspirin® jest zastrzeżoną nazwą handlową kwasu acetylosalicylowego, leku dostępnego bez recepty, używanego w sytuacji bólu, gorączki lub stanu zapalnego. Kwas acetylosalicylowy zapobiega również infekcjom i uszkodzeniom naczyń krwionośnych. Skuteczność leku zależy w dużej mierze od jego trwałości. Jedną z przyczyn utraty skuteczności może być hydroliza leku w roztworze wodnym. Kwas acetylosalicylowy może ulegać hydrolizie zgodnie z poniższym równaniem reakcji:
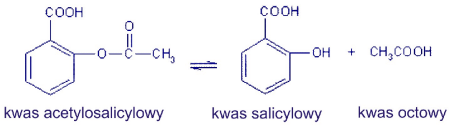
Produkt reakcji, kwas salicylowy, tworzy z jonami Fe3+ związki kompleksowe o intensywnym niebiesko-fioletowym zabarwieniu. Intensywność barwy zależy od stężenia kwasu salicylowego w roztworze.
2.3 Aparatura i odczynniki
- Aspirin® 100,
- Kwas salicylowy (kwas 2-hydroksybenzoesowy),
- Azotan(V) żelaza(III) Fe(NO3)3·10 H2O,
- Stężony kwas azotowy(V) HNO3,
- Etanol (95%),
- Zlewki, plastikowe buteleczki z wkraplaczem, kolby miarowe 250, 100 i 25 ml, pipety.
Zagrożenia
|

|
Salicylic
acid
Inhalation
causes irritation
of the mucous membrane
and upper respiratory
tract. Contact with
skin causes irritation
and possible burns,
especially if the
skin is wet or moist.
If absorbed, may
cause symptoms similar
to those for ingestion.
May cause skin rash
and eruptions.
R 22-41, S 22-24-26-39
|
|

|
Iron(III)
nitrate(V) (decahydrate)
Inhalation
causes respiratory
tract irritation.
May cause methemoglobinemia,
cyanosis, convulsions,
tachycardia, dyspnoea,
and death. May cause
acute pulmonary
edema, asphyxia,
chemical pneumonitis,
and upper airway
obstruction caused
by edema. Skin contact
may cause severe
irritation and possible
burns.
R 8-36/38, S
26
|
|
Nitric(V)
acid
Inhalation causes
respiratory tract
irritation, delayed
effects, pulmonary
function changes,
chemical pneumonitis,
pulmonary edema,
and dyspnoea may
occur. Contact with
skin causes severe
burns, ulceration,
scarring, dermatitis,
and yellow staining
of the skin may
be observed.
R 8-35, S 23.2-26-36-45
|
 |
|

|
Ethanol
Inhalation may
cause dizziness
or suffocation.
Contact with skin
causes moderate
skin irritation.
R 11, S 7-16
|
2.4 Procedura
Przygotowania krzywej kalibracyjnej:
- Wprowadź 0,100 g kwasu salicylowego do kolby miarowej 100 ml, rozpuść kwas w mieszaninie 10 ml etanolu i 10 ml wody dejonizowanej. Uzupełnij zawartość kolby wodą dejonizowaną do kreski miarowej.
- Odmierz 2,5 ml roztworu kwasu salicylowego i rozcieńcz do 25 ml mieszaniną 1:1 wody i etanolu w kolbie miarowej 25 ml. Oznacz roztwór jako roztwór A.
- Przenieś roztwór A do plastikowej buteleczki wyposażonej we wkraplacz.
- W kolbie miarowej 25 ml rozpuść 1,00 g Fe(NO3)3·10 H2O w 20 ml wody dejonizowanej, dodaj 1 ml stężonego HNO3 i uzupełnij zawartość kolby wodą do 25 ml. Oznacz roztwór jako roztwór B.
- Przenieś roztwór B do plastikowej buteleczki wyposażonej we wkraplacz.
- Przygotuj roztwory w zagłębieniach blistra zgodnie z następującymi wskazówkami:
Zagłębienie |
1.
r.odn. |
2. |
3. |
4. |
5. |
6. |
7. |
8. |
9. |
Roztwór A |
0  |
1  |
2  |
3  |
4  |
5  |
6  |
7  |
8  |
Roztwór B |
1  |
1  |
1  |
1  |
1  |
1  |
1  |
1  |
1  |
Woda dejonizowana |
8  |
7  |
6  |
5  |
4  |
3  |
2  |
1  |
0  |
T (%) |
|
|
|
|
|
|
|
|
|
A |
|
|
|
|
|
|
|
|
|
Stężenie kwasu salicylowego
[mg dm-3] |
- |
12,5 |
25,0 |
37,5 |
50,0 |
62,5 |
75,0 |
87,5 |
100 |
- Do pomiarów transmitancji użyj zielonej diody.
Zapisz wyniki pomiarów w tabeli powyżej i oblicz wartości absorbancji.
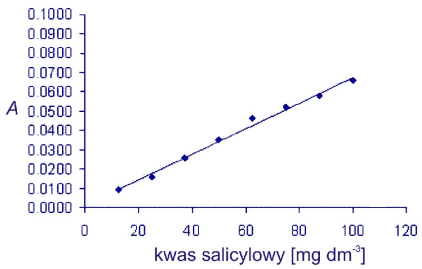
Sporządź krzywą kalibracyjną:
Krzywa kalibracyjna:
Hydroliza kwasu acetylosalicylowego w tabletce Aspirin
- Zważ tabletkę Aspirin 500 i rozpuść ją w 10 ml mieszaniny 1:1 etanolu z wodą.
- Przesącz roztwór do kolby miarowej 250 ml, przemyj sączek 10 ml mieszaniny 1:1 etanolu z wodą i rozcieńcz zawartość kolby do 250 ml wodą dejonizowaną. Przenieś roztwór do plastikowej buteleczki z wkraplaczem.
- Przygotuj roztwór odniesienia (1
 roztworu B i 8 roztworu B i 8  wody dejonizowanej) i ustaw transmitancję dla zielonej diody na 100,0. wody dejonizowanej) i ustaw transmitancję dla zielonej diody na 100,0.
- W kolejne zagłębienie blistra wprowadź 8
 roztworu aspiryny i 1 roztworu aspiryny i 1  roztworu B. roztworu B.
- Zmierz transmitancję roztworu natychmiast po jego sporządzeniu, rozpocznij pomiar czasu.
- Powtarzaj pomiary transmitancji, np. po 3 godzinach, 24 godzinach i 48 godzinach. Przed każdym pomiarem ustawiaj transmitancję dla zielonej diody na 100,0 przy pomocy roztworu odniesienia, jak to opisano w pkt. 3.
Oblicz wartości absorbancji i zapisz je w poniższej tabeli:
| Roztwór aspiryny
|
Transmitancja
[%]
|
Absorbancja
|
| Pomiar bezpośredniu po sporządzeniu roztworu
|
98,8
|
0,005
|
| Pomiar po 3 godzinach
|
98,0
|
0,009
|
| Pomiar po 24 godzinach
|
94,0
|
0,025
|
- Na podstawie przebiegu krzywej kalibracyjnej przedyskutuj przyczyny wzrostu absorbancji.
- Powtórz doświadczenie, lecz tym razem trzymaj buteleczkę z roztworem aspiryny w łaźni wodnej o podwyższonej temperaturze (np. 70°C), zapisując temperaturę łaźni i czas pomiaru.
- Porównaj wyniki otrzymane w temperaturze pokojowej i w podwyższonej temperaturze, przedyskutuj różnice.
Przykład
Temperatura pokojowa
Zmierzone wartości absorbancji wynosiły: 0,005 po sporządzeniu roztworu, 0,009 po 3 godzinach i 0,025 po 24 godzinach. Te wyniki wskazują, że hydroliza kwasu acetylosalicylowego zachodzi w temperaturze pokojowej bardzo wolno, czemu towarzyszy wzrost stężenia kwasu salicylowego, który tworzy barwny produkt z jonami żelaza(III).
Podwyższona temperatura
Zmierzone wartości absorbancji dla roztworów ogrzewanych w temperaturze 70°C wynosiły: 0,016 po 15 minutach, 0,032 po 30 minutach, 0,071 po 45 minutach i 0,090 po 60 minutach. Wyniki te wskazują, że szybkość hydrolizy kwasu acetylosalicylowego zależy od temperatury i jest znacznie wyższa w podwyższonej temperaturze.
Opracowanie: Margareta Vrtačnik*, Vida Mesec* i Nataša Gros**
*Uniwersytet w Lublanie, Wydział Nauk Przyrodniczych i Inżynierii
**Uniwersytet w Lublanie, Wydział Chemii i Technologii Chemicznej
|

