|

OZNACZENIE ZAWARTOŚCI JONÓW AMONOWYCH
W WODZIE
Cel
Wyznaczenie krzywej kalibracyjnej i wyznaczenie zawartości jonów amonowych w próbkach wody.
Wprowadzenie
Zawartość jonów amonowych i amoniaku w wodzie jest jednym ze wskaźników określających zanieczyszczenie wody.
Amoniak bardzo dobrze rozpuszcza się w wodzie. W wyniku reakcji z cząsteczkami wody tworzy jony amonowe NH4+, których oznaczenie stanowi przedmiot obecnego ćwiczenia.
Obecność amoniaku w wodzie zmienia jej smak i zapach. Progowa wartość wykrywania amoniaku węchem wynosi ok. 1,5 mg dm-3, a dla wykrywania smakiem ta wartość wynosi 35 mg dm-3 w roztworze wodnym.
Zawartość w wodach gruntowych i powierzchniowych zazwyczaj jest niższa niż 0,2 mg dm-3, w warunkach beztlenowych w wodach gruntowych wartość ta może wzrosnąć powyżej 3 mg dm-3.
Obecność jonów amonowych w wodzie jest skutkiem zanieczyszczeń komunalnych, rolniczych i przemysłowych. Jony te mogą się dostać do wody również wskutek dezynfekcji wody chloraminą, lub wskutek wymywania z rur betonowych.
opuszczalne stężenie jonów NH4+ w wodzie pitnej wynosi 0,50 mg dm-3. Wartości zalecane to 0,05 mg dm-3 w wodzie pitnej, 0,5 mg dm-3 w wodzie dla ryb i max. 0,1 mg dm-3 w wodzie dla basenów kąpielowych.
Podstawa pomiaru
Jony amonowe przy pH ok. 12,6 reagują z odczynnikami R1 i R2 z utworzeniem zielononiebieskiego związku nadającego się do oznaczeń spektrometrycznych. Do pomiarów należy użyć diody emitującej czerwone światło.
Stężenie jonów amonowych w roztworach kalibracyjnych mieści się w granicach 0,125 i 1,00 mg dm-3.
Sprzęt i odczynniki
Odczynniki:
- odczynnik R1,
- odczynnik R2,
- roztwór wzorcowy jonów amonowych 1,0 mg dm-3
Sprzęt:
- zlewka 50 ml,
- dwie zlewki 400ml,
- dwie kolby miarowe 1l,
- dwie kolby miarowe 500ml,
- pipety 10 ml
- spektrometr SpektraTM,
- blistry,
- buteleczki plastikowe 10 ml z zakraplaczem,
- waga laboratoryjna,
- waga analityczna
Zagrożenia
|
Chlorek amonu NH4Cl
R: 22–36
S: 22
|
|
Wodorotlenek sodu NaOH
R: 35
S: 1/2, 26- 36,37/39- 45
|
|
Salicylan sodu C7H5O3Na
R: 22-36
S: 24, 25
|
|
|
Nitroprusydek sodu (Pentacyjanonitrozożelazian sodu) Na2Fe(CN)5NO
R: 28-32-50/53
S: 7-28, 1-29-45-60-61
|
|
|
Dichloroizocyjanuran sodu C3Cl2N3NaO3
R: 8-22-31-36/37-50/53
S: 8-26-41-60-61
|
|
|
|
Cytrynian sodu Na3C6H5O7 |
Sposób postępowania
Wzorcowy roztwór jonów amonowych:
Odważ 0,2965 g chlorku amonu, rozpuść w niewielkiej ilości wody destylowanej, przenieś roztwór do kolby miarowej o pojemności 1 l, uzupełnij wodą destylowaną do kreski miarowej i dobrze wymieszaj. Przenieś 10 cm3 otrzymanego roztworu do innej kolby miarowej o pojemności 1 l i uzupełnij wodą destylowaną do kreski miarowej, wymieszaj.
Napełnij roztworem wzorcowym buteleczki plastikowe z zakraplaczami.
Odczynnik R1:
Rozpuść 75 g salicylanu sodu i 75 g cytrynianu sodu w około 350 cm3 wody destylowanej. Dodaj 0,47 g pentacyjanonitrozożelazianu sodu, rozpuść go, a następnie rozcieńcz roztwór do 500 cm3 wodą destylowaną w kolbie miarowej.
Odczynnik należy przechowywać w lodówce, trwałość roztworu wynosi 1 tydzień.
Napełnij odczynnikiem R1 buteleczki plastikowe z zakraplaczami.
Odczynnik R2:
Rozpuść 16,0 g wodorotlenku sodu w około 250 cm3 wody destylowanej. Ochłodź roztwór i dodaj 1,00 g dichlorocyjanuranu sodu. Rozpuść dodaną substancję i rozcieńcz roztwór wodą destylowaną do 500 cm3 w kolbie miarowej.
Napełnij odczynnikiem R2 buteleczki plastikowe z zakraplaczami.
Przygotowanie próbki:
Do badań można użyć wodę pitną, wodę powierzchniową, wodę gruntową, wodę z akwarium oraz wodę z basenów kąpielowych.
Jeżeli próbka wody jest mętna, należy ją przesączyć.
Napełnij próbkami wody buteleczki plastikowe z zakraplaczami.
Pomiary spektrometryczne:
- Przygotuj próbkę odniesienia i osiem roztworów kalibracyjnych odmierzając krople roztworów do blistra, zgodnie ze wskazówkami w tabeli 1.
Tabela 1:
|
Próbka odnies. |
CS1 |
CS2 |
CS3 |
CS4 |
CS5 |
CS6 |
CS7 |
CS8 |
Próbka |
Woda H2O |
8 |
7 |
6 |
5 |
4 |
3 |
2 |
1 |
- |
- |
Roztw. wzorc.
NH4+ |
- |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
- |
Próbka |
- |
- |
- |
- |
- |
- |
- |
- |
- |
8 |
R1 |
2 |
2 |
2 |
2 |
2 |
2 |
2 |
2 |
2 |
2 |
R2 |
2 |
2 |
2 |
2 |
2 |
2 |
2 |
2 |
2 |
2 |
T[%] |
|
|
|
|
|
|
|
|
|
|
A |
|
|
|
|
|
|
|
|
|
|
γ NH4+
[mg dm-3]
|
0 |
0,125 |
0,250 |
0,375 |
0,500 |
0,625 |
0,750 |
0,875 |
1,000 |
? |
- Transmitancję należy mierzyć po upływie 1 godziny, aby reakcja przebiegła do końca i barwa roztworu zmieniła się na zielononiebieską. Do pomiarów należy użyć diody emitującej czerwone światło.
- Przed pomiarem dla każdego roztworu należy ustawić wartość transmitancji na 100,0 dla próbki odniesienia.
- Wpisz zmierzone wartości transmitancji do tabeli.
- Oblicz wartości absorbancji i wpisz je do tabeli.
- Sporządź krzywą wzorcową, wyprowadź równanie otrzymanej prostej.
Wykres: krzywa kalibracyjna
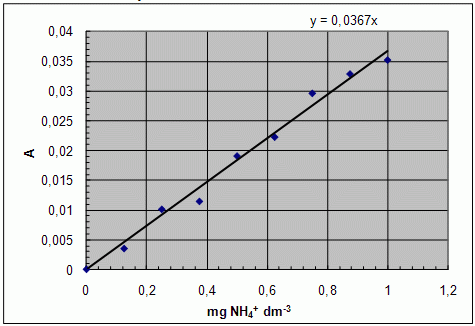
- Odczytaj z wykresu wartości stężenia jonów amonowych w próbkach wody. Możesz również obliczyć te wartości przy pomocy równania prostej.
- Podaj zawartość NH4+ w mg dm-3.
Wyniki
|
Próbka wody |
A |
|
γ NH4+
[mg dm-3]
|
|
Opracowanie: Romana Mele and Helena Prevc, ŠC SSKŠ Ljubljana |
