|

Oznaczanie witaminy E w oleju słonecznikowym metodą HPLC
Cel ćwiczenia
Celem ćwiczenia jest oznaczenie ilościowe witaminy E w oleju słonecznikowym z wykorzystaniem wysokosprawnej chromatografii cieczowej (HPLC).
Wprowadzenie
Witaminy s ą to niskocz ą steczkowe zwi ą zki organiczne, o ró ż norodnej budowie chemicznej, rozpowszechnione w ś wiecie ro ś linnym i zwierz ę cym. Związki te s ą niezb ę dne do wzrostu i podtrzymania funkcji ż yciowych. Dla wielu organizmów, w tym zwierz ą t i człowieka s ą to na ogół zwi ą zki egzogenne i musz ą by ć dostarczane z po ż ywieniem. Objawy wywołane całkowitym brakiem witamin zwane s ą awitaminozami . Cz ę sto wyst ę puj ą niedobory witamin, czyli stany po ś rednie mi ę dzy awitaminoz ą a optymalnym zaspokojeniem zapotrzebowania organizmu na okre ś lon ą witamin ę (hipowitaminozy). Na ogół s ą one spowodowane niewła ś ciwym od ż ywianiem, złym przyswajaniem witamin z pokarmu oraz zniszczeniem bakterii w przewodzie pokarmowym. Z kolei nadmierne przyjmowanie preparatów witaminowych, głównie witamin rozpuszczalnych w tłuszczach, mo ż e prowadzi ć do szkodliwych dla organizmu objawów, zwanych hiperwitaminozami.
Podstawow ą klasyfikacj ą witamin jest podział na:
- witaminy rozpuszczalne w tłuszczach,
- witaminy rozpuszczalne w wodzie.
Witamina E
Witaminy należące do grupy E są zbudowane z aromatycznego układu hydroksyfenylowego z łańcuchem tetraizopentenylowym, a ich zróżnicowanie polega na różnej liczbie i położeniu grup CH 3. Występują one w dużych ilościach – w kiełkach pszenicy (Triticum), sałacie siewnej (Lactuca sativa), nasionach soi (Glycine max). Obecnie wyizolowano 8 związków należących do dwóch grup witamin E, nazywanych odpowiednio tokoferolami i tokotrienolami.
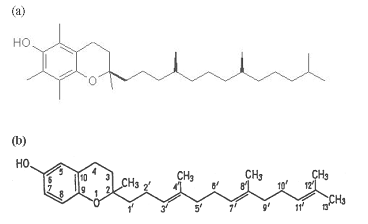
Rys. 5. Struktury zwi ą zków chemicznych: (a) - tokolu, (b) – tokotrienolu
Witaminy E w temperaturze pokojowej s ą substancjami oleistymi, nierozpuszczalnymi w wodzie, łatwo rozpuszczalnymi w tłuszczach. W ś rodowisku beztlenowym s ą odporne na działanie wysokiej temperatury (do 200°C) oraz kwasów i zasad. Witaminy te s ą bardzo wra ż liwe na działanie promieni UV oraz tlenu. W obecno ś ci soli ż elaza łatwo ulegaj ą utlenieniu, tworz ą c dimery, trimery i chinony. Ich wra ż liwo ść wzrasta z liczb ą grup metylowych w cz ą steczce. Podczas przyjmowania ż elaza nie powinno si ę jednocze ś nie stosowa ć witaminy E.
Na podstawie wielu obserwacji prowadzonych na zwierz ę tach do ś wiadczalnych stwierdzono, ż e witamina E jest odpowiedzialna za prawidłowe funkcjonowanie narz ą dów rozrodczych. U dorosłego człowieka nie zaobserwowano dot ą d charakterystycznych symptomów jej braku. U dzieci stwierdzono dodatni wpływ witaminy E na wytwarzanie czerwonych krwinek w przypadku anemii.
Zgodnie z aktualnymi pogl ą dami zapotrzebowanie dorosłego człowieka na t ę witamin ę waha si ę w granicach 10-30 mg α-tokoferolu na dzie ń . Witamin ę E wyra ż a si ę w tabelach ż ywieniowych jako "równowa ż nik α-tokoferolu" w mg. α-tokoferol wykazuje 100% bioaktywno ś ci.
1 mg równowa ż nika α-tokoferolu = 1 mg czystej formy α-tokoferolu
W praktyce stosuje si ę zarówno naturalne, jak i syntetyczne tokoferole. Koncentraty naturalnej witaminy E otrzymuje si ę z olejów ro ś linnych (jest to mieszanina tokoferoli z przewa ż aj ą c ą ilo ś ci ą α-tokoferolu). Bogatym ź ródłem tej witaminy s ą oleje ro ś linne, zwłaszcza z kiełków pszenicy, sojowy i bawełniany. Z innych produktów wymieni ć nale ż y: sałat ę , szpinak, kapust ę , masło, jaja.
Wysokosprawna chromatografia cieczowa (HPLC)
Chromatografia cieczowa jest metod ą rozdzielania składników mieszanin w wyniku ich ró ż nego podziału mi ę dzy faz ę ruchom ą i stacjonarną. Na skutek oddziaływań międzycząsteczkowych między związkami chemicznymi będącymi składnikami analizowanej próbki a wypełnieniem kolumny następuje ich rozdział. Analizowana próbka, jest rozpuszczana w odpowiednio dobranym rozpuszczalniku, zależnym od właściwości substancji i zastosowanego układu (czasem stosuje się fazę ruchomą) i w formie roztworu o znanym stężeniu i objętości jest kierowana na kolumnę, która wypełniona jest specjalnym złożem porowatym lub żelowym. Związki chemiczne, które silniej oddziałują ze złożem przepływają wolniej przez kolumnę, zaś związki chemiczne, które oddziałują słabiej ze złożem przepływają szybciej. Rolę fazy ruchomej pełni odpowiednio dobrana mieszanina (tzw. eluent). W HPLC duże znaczenie dla rozdziału ma polarność faz. Początkowo, stosowano normalny układ faz (NP), w którym faza stacjonarna jest znacznie bardziej polarna niż faza ruchoma (np. układ: żel krzemionkowy – heksan). Obecnie najczęściej stosuje się odwrócony układ faz (RP – układ faz odwróconych), w którym faza stacjonarna jest mniej polarna niż faza ruchoma, np. układ: żel krzemionkowy z chemicznie modyfikowaną powierzchnią – mieszanina metanolu, acetonitrylu, wody, specjalnie dobranych buforów. Detektorem stosowanym do analizy witaminy E może być detektor spektrofotometryczny UV. Działa na zasadzie pomiaru absorpcji promieniowania UV. Miarą sygnału z detektora jest wysokość (lub powierzchnia) sygnału chromatograficznego.
Oznaczanie zawartości witamin rozpuszczalnych w tłuszczach przeprowadza się z zastosowaniem wysokosprawnej chromatografii cieczowej z detekcją spektrofotometryczną. W większości przypadków konieczne jest zmydlenie badanego materiału oraz odpowiednia ekstrakcja.
Odczynniki
- metanol o czystości do HPLC,
- acetonitryl o czystości do HPLC,
- woda dejonizowana,
- bezwodny siarczan sodu,
- fenoloftaleina, etanol (98 %),
- 0,5 M roztwór KOH w etanolu,
- eter naftowy,
- α-tokoferol
Zagrożenia
Nazwa |
Rodzaj zagrożenia i sposoby bezpiecznego postępowania |
Symbol i oznaczenie zagrożenia produktu |
Acetonitryl |
R: 11; R:20/21/22-36
S: 1/2-16-36/37 |
F, Xn
 
|
Metanol |
R: 11-23/24/25-39/23/24/25
S: (1/2) 7-16-36/37-45 |
F, T
 
|
Etanol |
R: 11
S: 7, S: 16 |
F

|
0,5 M roztwór KOH w etanolu |
R: 11
S: (1/2)-7-16-26-36/37/39-45 |
F

|
Fenoloftaleina |
R:40
S: 36/37 |
Xn
 |
Eter naftowy |
R: 45-65
S: 53-45 |
T
  |
aα-tokoferol |
Produkt nie jest niebezpieczn ą substancj ą chemiczn ą / preparatem chemicznym w rozumieniu przepisów.
Nie jest wymagane stosowanie symboli i napisów ostrzegawczych |
|
Materiały i sprzęt
- rozdzielacze 500 ml – 2 szt.,
- lejek szklany – 4 szt.,
- kolba sercowa,
- 250 ml – 1 szt.,
- naczynka zakręcane o poj. 2 ml – 2 szt.,
- zlewki 250 ml – 2 szt.,
- strzykawka szklana 100 µl – 1 szt.,
- kolba okrągłodenna 100 ml – 1 szt.,
- łaźnia wodna,
- chłodnica zwrotna,
- cylinder miarowy 50 ml – 2 szt.; 100 ml – 2 szt.,
- sączki,
- filtr membranowy 0,45 µm – 1 szt.
Procedura
Zmydlanie
Do kolby okrągłodennej odważyć (z dokładnością do 0,01 g) 5 g próbki oleju słonecznikowego. Kolbę zabezpieczyć folią aluminiową przed dostępem światła. Dodać kolejno ok. 1-2 g kwasu askorbinowego oraz 60 ml 0,5 M roztworu KOH w etanolu. Podłączyć chłodnicę i umieścić kolbę na łaźni wodnej o temp. ok. 95 °C. Zmydlanie prowadzić 45 min. Zmydlony roztwór przenieść, dekantując do rozdzielacza. Kolbę po zmydlaniu płukać etanolem (3 razy po 5 ml), popłuczyny dołączyć do zmydlonego roztworu znajdującego się w rozdzielaczu. Następnie do zmydlonego roztworu próbki dodać taką ilość wody, aby stosunek etanolu do wody w roztworze końcowym wynosił 2:1 (v/v).
Ekstrakcja witaminy E eterem naftowym
Witaminę E ekstrahować 70 ml eteru naftowego. Warstwę eteru naftowego przenieść do drugiego rozdzielacza. Powtórzyć ekstrakcję jeszcze 2-krotnie, używając każdorazowo po 50 ml eteru naftowego. Połączone ekstrakty przemyć 50 ml wody, ostrożnie mieszając, aby zapobiec powstawaniu zawiesiny. Powtórzyć przemywanie kolejnymi porcjami wody (4 x 50 ml wody), aż woda pozostanie bezbarwna po dodaniu 1 % roztworu fenoloftaleiny. Usunąć ślady wody przez zastosowanie siarczanu sodu. Tak przygotowany ekstrakt eterowy odparować do sucha na odparowywaczu obrotowym (temp. łaźni wodnej 30 °C). Pozostałość rozpuścić w 2 ml acetonitrylu. Przenieść po 1 ml roztworu próbki do 2 buteleczek. Pierwszą z nich poddać analizie HPLC (3 powtórzenia), a do drugiej próbki dodać 20 µl roztworu witaminy E o stężeniu 1,56 mg/ml i wykonać analizę HPLC (3 powtórzenia)
Warunki analizy HPLC: kolumna HPLC C18, przepływ fazy ruchomej 0,8 ml/min, długo ść fali λ = 292 nm, faza ruchoma acetonitryl/metanol 80:20, (v/v).
Opracowanie wyników
Zmierzy ć powierzchnie sygnału witaminy E na chromatogramach próbki ekstraktu oleju słonecznikowego bez i z dodatkiem wzorca. Otrzymane wyniki zestawić w Tabeli 1. Nast ę pnie obliczy ć zawarto ść witaminy w próbce oleju, korzystając ze wzoru (1) i (2).
Tabela 1. Wyniki analizy HPLC dla roztworu wzorcowego witaminy E i ekstraktu oleju słonecznikowego
Pole powierzchni |
Pomiar 1 |
Pomiar 2 |
Pomiar 3 |
Średnie pole powierzchni |
Próbka ekstraktu oleju słonecznikowego bez dodatku wzorca witaminy E |
|
|
|
|
Próbka ekstraktu oleju słonecznikowego z dodatkiem wzorca witaminy E |
|
|
|
|
c = Y0· cs / ( Yi – Y0) |
(1) |
gdzie:
Y0– oznacza pole powierzchni lub wysoko ść sygnału chromatograficznego witaminy E zmierzony dla próbki bez dodatku wzorca,
Yi– pole powierzchni lub wysoko ść sygnału chromatograficznego witaminy E zmierzony dla próbki po dodaniu wzorca,
c – st ęż enie witaminy E w próbce badanej,
cs – st ęż enie wzorca witaminy E w próbce.
St ęż enie dodanego wzorca witaminy E w próbce (cs) obliczmy ze wzoru:
gdzie:
Vp – obj ę to ść próbki,
cwz– st ęż enie roztworu wzorca witaminy E, który dodajemy do próbki,
Vwz - obj ę to ść roztworu wzorca witaminy E, który dodajemy do próbki.
Opracowanie: Faculty of Chemistry, University ob Gdansk, Poland
|