|

Izolacja oraz identyfikacja wybranych barwników roślinnych
Cel
Celem ćwiczenia jest wyizolowanie barwników z materiału roślinnego (susz papryki, natka pietruszki), rozdział metodą cienkowarstwowej chromatografii (TLC) oraz ich identyfikacja.
Wprowadzenie
Barwniki są to związki chemiczne absorbujące promieniowanie elektromagnetyczne w zakresie widzialnym (400 do 780 nm), warunkujące barwę organizmów roślinnych i zwierzęcych albo nadające barwę przedmiotom użytkowym.
Barwniki dzieli się na naturalne, występujące w owocach, warzywach, jadalnych częściach roślin (np. karoten, chlorofile, antocyjany) i w tkankach zwierzęcych (np. mioglobina i hemoglobina) oraz barwniki syntetyczne, niewystępujące naturalnie w przyrodzie (np. żółcień chinolinowa, żółcień pomarańczowa czy czerwień koszenilowa).
W produkcji żywności stosowane są także barwniki identyczne z naturalnymi, czyli substancje barwiące występujące naturalnie ale uzyskiwane na drodze syntezy chemicznej.
Barwniki naturalne dzieli się w zależności od ich budowy chemicznej. Najbardziej rozpowszechnione to:
- karotenoidy - barwniki izoprenoidowe, chlorofile, mioglobina i hemoglobina - barwniki porfirynowe,
- antocyjany - barwniki flawonoidowe i inne.
Barwniki izoprenoidowe są pochodnymi rozgałęzionych węglowodorów zawierających 40 atomów węgla, zwanych tetraterpenami. W ich cząsteczkach obecnych jest wiele sprzężonych wiązań podwójnych (polieny, prawie wyłącznie o konfiguracji trans), które są przyczyną intensywnej barwy tych związków. Poszczególne związki różnią się stopniem uwodornienia, występowaniem i strukturą form cyklicznych na końcach łańcucha, a także obecnością tlenu w cząsteczce(ksantofile)lub jego brakiem (karoteny). Mogą one tworzyć związki acykliczne (likopen), monocykliczne (γ-karoten) lub bicykliczne (α-karoten i β-karoten) (rys. 1.). Barwniki karotenoidowe są koloru od żółtego poprzez pomarańczowy do czerwonego i występują w kwiatach, nasionach, owocach, korzeniach, a także zielonych częściach roślin.
Karotenoidy uważane są za najefektywniejsze naturalne „wygaszacze” tlenu singletowego, stąd ich aktywność przeciwutleniająca i wynikające z niej cenne właściwości biologiczne. Karotenoidy, które w cząsteczce posiadają pierścień β -jonowy wykazują aktywność prowitaminy A, przy czym najwyższą aktywnością prowitaminową charakteryzuje się β -karoten, gdyż na obydwu końcach łańcucha posiada pierścienie o konfiguracji β (rys.1).
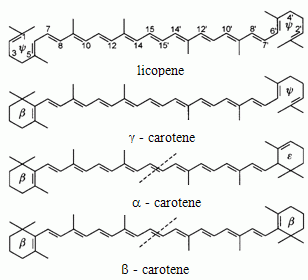
Struktura chemiczna wybranych karotenoidów.
Podstawowym procesem pozwalającym wyodrębnić związki organiczne z surowców roślinnych jest ekstrakcja typu ciało stałe–ciecz. Polega ona na wybiórczym przenoszeniu substancji do roztworu (rozpuszczaniu) znajdującej się w stałej próbce. Proces ten często nazywany jest ługowaniem. Wydajność ekstrakcji zależy głównie od rozpuszczalności substancji w danym rozpuszczalniku. Najczęściej stosowana jest ekstrakcja ciągła w aparacie Soxhleta pokazanym na poniższym
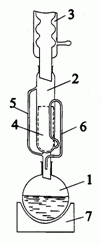
Zestaw do ekstrakcji w aparacie Soxhleta: kolba kulista (1), ekstraktor (2)z gilzą (4), który posiada rurkę (5) umożliwiającą przechodzenie par rozpuszczalnika do chłodnicy zwrotnej(3) oraz zamknięcie syfonowe (6), płaszcz grzejny (7).
Wyizolowaną mieszaninę barwników najczęściej rozdziela się na poszczególne związki metodami chromatograficznymi. Wykorzystuje się zarówno chromatografię kolumnową jak i chromatografię planarną.
Chromatografia planarna jest tym rodzajem chromatografii cieczowej, w której faza stacjonarna tworzy płaszczyznę. Wykonuje się ją na bibule lub na cienkich warstwach sorbentów osadzonych na płytkach (TLC, Thin Layer Chromatography).
W chromatografii cienkowarstwowej substancje rozdzielane poruszają się wraz z rozpuszczalnikiem organicznym (ciekła faza ruchoma) przez cienką warstwę stałego adsorbenta (faza stacjonarna) naniesionego na płytkę . Towarzyszą temu procesy adsorpcji i desorpcji oraz podział między ciekłą fazą organiczną i wodę, która w niewielkich ilościach znajduje się na adsorbencie. Zjawiska adsorpcji, desorpcji i podziału sprawiają, że poszczególne substancje poruszają się z różną prędkością, wynikiem czego następuje rozdział mieszaniny na poszczególne składniki.
Substancje analizowane w postaci roztworu nanosi się za pomocą kapilarki na płytkę TLC w pewnej odległości od brzegu a następnie, zanurza płytkę w niewielkiej ilości rozpuszczalnika znajdującego się w zamkniętej komorze. Wznoszący się rozpuszczalnik powoduje migrację substancji po powierzchni złoża, proces ten nazywa się rozwijaniem chromatogramu. Gdy czoło rozpuszczalnika osiągnie linię mety (można ją wcześniej zaznaczyć) płytkę wyjmuje się z komory, suszy i analizuje. W przypadku analizy związków bezbarwnych plamki na chromatogramie wizualizuje się za pomocą reakcji dających barwne produkty lub innymi metodami, jak obserwacja w świetle UV.
W chromatografii cienkowarstwowej wielkością charakteryzującą badaną substancję jest współczynnik R f, definiowany jako stosunek drogi (d) przebytej przez środek plamy substancji do drogi (f) czoła fazy ruchomej (rys. 3).

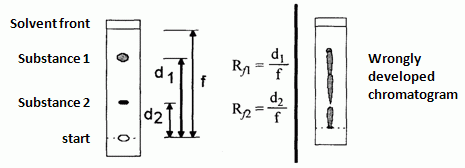
Rys. 3. Przykładowy chromatogram TLC mieszaniny dwuskładnikowej: a) wykonany prawidłowo, b) wykonany nieprawidłowo
(www.chemia.uj.edu.pl/dydaktyka/biofiz2009.pdf).
Wartość R f może zmieniać się od 0 do 1. Jeśli R f = 0 oznacza to, że chromatografowana substancja w danym układzie chromatograficznym zbyt silnie jest adsorbowana przez adsorbent i nie przenosi się wraz z fazą ruchomą (substancja pozostaje na starcie). Z kolei R f = 1 świadczy o tym, że substancja wcale nie jest zatrzymywana przez fazę stacjonarną i wędruje z prędkością rozpuszczalnika. Optymalna wartość współczynnika R f powinna zawierać się w przedziale 0,2-0,8. Wartość współczynnika R f, zależy od rodzaju analitu, rodzaju fazy ruchomej i fazy stacjonarnej, a także nasycenia komory i temperatury.
Odczynniki
- suszona papryka, słodka,
- natka pietruszki,
- chloroform cz.d.a.,
- aceton cz.d.a.,
- eter naftowy cz.d.a.,
- n-heksan cz.d.a.,
- 10% roztwór wodny NaCl,
- węglan wapnia CaCO3 cz.d.a.,
- bezwodny siarczan(VI) sodu, Na2SO4,
- płytki z żelem krzemionkowym Silica Gel 60 (Merck),
- E 160c (zawiera kapsantynę i kapsorubinę),
- E 160a(ii) (zawiera β-karoten).
Zagrożenia
substancja |
Zwroty R i S |
Piktogramy zagrożeń |
Aceton |
R: 36-66-67
S: (2-)9-16-26 |
 
|
Chloroform
|
R: 22-38-40-48/20/22
S: (2-)36/37 |

|
Eter naftowy
|
R: 45-65
S: 53-45 |
 
|
n-heksan
|
R: 38-48/20-51/53-62-65-67
S: (2-)9-16-29-33-36/37-61-62 |
  
|
Sodium carbonate |
S: 22 |
|
Materiały i sprzęt laboratotryjny
- waga analityczna ,
- zestaw do ekstrakcji w aparacie Soxhleta (pojemność kolby okrągłodennej 250 cm 3),
- wyparka rotacyjna ,
- cylinder miarowy poj. 200 cm 3 - 1 szt.,
- cylinder miarowy poj. 50 cm 3 - 3 szt
- lejek szklany 2 szt.,
- moździerz porcelanowy
- kolba stożkowa 50 cm 3 2 szt.,
- kolba sercówka 100 cm 3 z korkiem 1 szt.,
- kolba sercówka 50 cm 3 z korkiem 1 szt.,
- rozdzielacz poj. 50 cm 3,
- kamyki wrzenne,
- bibuła filtracyjna (na gilzę, jeśli nie ma firmowej i na sączki),
- wata,
- komora chromatograficzna 1 szt.,
- kapilarki szklane.
Procedura
Ekstrakcja barwników z suszu papryki w aparacie Soxhleta
Odważ do gilzy10 g suszonej papryki, od góry gilzę zamknij watą i całość umieść w nasadce ekstrakcyjnej. Do kolby okrągłodennej (pojemność 250 ml) wprowadź kamyki wrzenne, wlej 120 chloroformu, kolbę umieść w płaszczu grzejnym, zamontuj na niej aparat Soxhleta i chłodnicę zwrotną. Włącz przepływ wody chłodzącej i rozpocznij ogrzewanie. Utrzymuj stan łagodnego wrzenia przez 1,5-2 godziny (czas ekstrakcji). Wyłącz ogrzewanie, ekstrakt przenieś sukcesywnie do kolby sercówki o poj. 100 mL i zatęż do ok. 10% początkowej objętości roztworu.
Ekstrakcja barwników z liści pietruszki
W moździerzu utrzyj 5 g rozdrobnionych liści pietruszki w 20 mL mieszaniny aceton : eter naftowy (22:3; v/v). W trakcie rozcierania dodaj ok. 0,5 g węglanu wapnia. Mieszaninę przesącz do rozdzielacza przez sączek z bibuły. Do ekstraktu dodaj 20 mL eteru naftowego i 20 mL 10% roztworu NaCl, po czym intensywnie wytrząsaj przez 2 - 3 min. Po rozdzieleniu się warstw, dolną wodną warstwę usuń a warstwę organiczną przemyj trzykrotnie 5 mL porcjami wody destylowanej. Przemyty ekstrakt przenieś do kolby stożkowej, dodaj bezwodny Na 2SO 4 w celu usunięcia wody i przenieś ekstrakt do kolby sercówki. Ekstrakt zatęż do 20 – 30% początkowej objętości roztworu na wyparce próżniowej.
Analiza TLC ekstraktów
Do komory chromatograficznej wprowadź niewielką ilość mieszaniny n-heksanu i acetonu o stosunku objętościowym 7:3 (v/v), zamknij komorę i kondycjonuj układ około 15 min. Z płytki żelu krzemionkowego wytnij fragment o wymiarach 4,5 cm x 8,5 cm, zaznacz ołówkiem linię startu i miejsca naniesienia próbek: wzorcowych barwników (punkty 1 i 3), ekstraktu z papryki (punkt 2) i ekstraktu z zielonej pietruszki (punkt 4). Nanieś kapilarką powyższe roztwory na płytkę (1-2 kropelki) susząc płytkę strumieniem ciepłego powietrza z suszarki. Średnica plamek nie powinna przekraczać 5 mm. Płytkę umieść w komorze chromatograficznej tak, by słup cieczy był poniżej plamek i zamknij komorę. Po rozwinięciu chromatogramu zaznacz ołówkiem czoło rozpuszczalnika, odparuj suszarką rozpuszczalnik i oblicz współczynniki R f dla poszczególnych składników ekstraktów. Na ich podstawie dokonaj identyfikacji barwników w analizowanych ekstraktach.
Opracowanie: Faculty of Chemistry, University ob Gdansk, Poland
|