|

OCENA UČINKOVITOSTI METOD ODSTRANJEVANJA BAKROVIH IONOV IZ ODPADNIH VOD
V proizvodnji bakra iz bakrovih rud, kakor tudi v proizvodnji tiskanih vezij, barv in lakov, zaščitnih sredstev za les, procesih galvanizacije in drugih predelavah kovin, nastaja velika količina odpadnih vod z visoko vsebnostjo bakrovih ionov. Ker so bakrovi ioni za vodne organizme zelo toksični, je potrebno pred izpustom odpadnih vod v okolje, odstraniti bakrove ione iz vodnih raztopin. Kot posledica prehranske verige lahko prihaja tudi do bioakumulacije bakrovih ionov iz vodnih mikroorganizmov v ribe in ob uživanju rib posredno tudi v človeški organizem.
Tabela 1: Primera bakrovih rud (vir: Wikipedija)
Malahit - CuCO3.Cu(OH)2 |
Halkopirit - CuFeS2 |
|
|
Za odstranjevanje bakrovih ionov iz odpadnih vod sta primerna dva postopka:
Pri obeh postopkih dobimo trdne produkte, ki jih lahko shranimo na posebej pripravljenih odlagališčih industrijskih odpadkov ali pa jih recikliramo, preostanek po filftraciji pa lahko, v kolikor ima ustrezen pH in ne vsebuje okolju škodljivih onesnaževal, zavržemo.
Vaša naloga
Tudi v šolskih laboratorijih se pri vajah velikokrat uporablja vodna raztopina Cu2+ ionov, zato so šolski laboratoriji pomemben izvor odpadnih vod z znatno vsebnostjo bakrovih ionov, ki jih ne smemo preprosto zlivati v lijake. Vaša naloga je, da na osnovi rezultatov eksperimentov, izberete najbolj učinkovit postopek za odstranjevanje bakrovih ionov iz odpadnih raztopin bakrovih ionov. Reagenti, ki so na voljo tako za obarjanje, kakor tudi za redukcijo bakrovih ionov, so podani na Shemi 1.
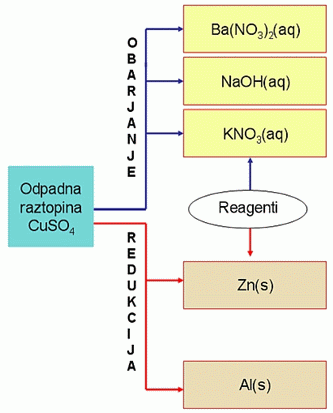
Shema 1: Reagenti za odstranjevanje bakrovih ionov
Varnost pri delu
Pri delu morate obveznosti nositi zaščitna očala, rokavice in laboratorijsko haljo.
Ba(NO3)2 – draži kožo in sluznice, ni vnetljiv, z vodo ne reagira, vendar pri segrevanju razpada v toksične dušikove okside.
NaOH – močno koroziven in toksičen ob zaužitju, ob stiku s kožo povzroča opekline, pri daljšem kontaktu pa dermatitis, ne gori, v vodi razpade na natrijeve in hidroksidne ione, zato so vodne raztopine močne baze.
R 35, S 26, 37/39, 45
KNO3 – oksidant, na kožo in sluznice deluje dražeče, vendar ni toksičen, ni vnetljiv, pri segrevanju razpada v toksične dušikove okside, z vodo ne reagira.
Reagenti in potrebščine
- Odpadna voda, ki vsebuje bakrove ione (dal vam jo bo učitelj)
- CuSO4 (aq) – 0,5 mol/L
- Ba(NO3)2(aq) – 1 mol/L
- NaOH(aq) – 1 mol/L
- KNO3(aq) – 1 mol/L
- Al folija
- Cinkove granule (male) ali ploščica
- Blistri
- Deionizirana voda
- Epruvete in stajalo
- Kapalne stekleničke
- Steklene palčke
- Trije manjši liji
- Filtrirni papir
- Spektrometer SpektraTM
Izvedba po stopnjah
1. Priprava umeritvene premice
Z uporabo sheme za pripravo umeritvene premice (Tabela 1) pripravite v vdolbinicah blistra razredčene raztopine CuSO4(aq). Vodo in standardno raztopino CuSO4(aq) ste dobili v kapalnih stekleničkah.
Tabela 2: Priprava raztopin bakrovega sulfata za pripravo umeritvene premice
Raztopine |
1. |
2. |
3. |
4. |
5. |
6. |
7. |
8. |
9. |
Slepa |
CuSO4(aq) kapljice
|
1
|
2 |
3 |
4 |
5 |
6
|
7 |
8 |
9 |
|
Deionizirana voda, kapljice |
8 |
7 |
6 |
5 |
4 |
3 |
2 |
1 |
0 |
9 |
c [mol/L]
|
0,056 |
0,111 |
0,167 |
0,222 |
0,278 |
0,333 |
0,389 |
0,444 |
0,500 |
0,0 |
T
|
|
|
|
|
|
|
|
|
|
|
A
|
|
|
|
|
|
|
|
|
|
|
Za merjenje transmitance uporabite rdečo LED. Uravnajte transmitanco s slepo na 100% in nato izmerite transmitance raztopin ter podatke vpišite v Tabelo 2.
2. Z uporabo programa Excel izračunajte absorbance in pripravite umeritveno premico.
Graf 1: Umeritvena premica
3. V šest epruvet dodajte reagente po shemi v Tabeli 3.
Tabela 3: Priprava reakcijskih zmesi
Epruvete/ reagenti
|
1.
Ba(NO3)2(aq) |
2.
NaOH(aq)
|
3.
KNO3(aq)
|
4.
Zn(s)
|
5.
Al(s)
|
6.
Primerjalna
|
Volumen/masa [ml] oz. [g] |
4 |
4 |
4 |
2g* |
0,5 g* |
|
Voda [ml] |
0 |
0 |
0 |
4 |
4 |
4 |
Cu2+(odp) [ml] |
6 |
6 |
6 |
6 |
6 |
6 |
* Uporabite majhne granule Zn, da je reakcijska površina čim večja. V primeru Al uporabite Al-folijo, ki jo zmečkajte, da bo površina kar največja.
4. Vsebino epruvet pretresite. Počakajte 15 - 20 minut, da se filtrati nad oborinami zbistrijo. Filtrirajte vsebino 1. in 2. epruvete (oborine), po potrebi tudi 4. epruvete (delčki bakra) v označene kapalne stekleničke. Bistre raztopine samo prelijte v kapalne stekleničke.
5. V jamice blistra dodajte po 9 kapljic filtratov, v zadnjo jamico pa devet kapljic izhodne odpadne raztopine bakrovega sulfata. Kot slepo v poenostavljeni izvedbi uporabite kar deionizirano vodo. Izmerite transmitanco in izračunajte absorbanco ter iz umeritvene premice odčitajte koncentracijo bakrovih ionov v filtratu po reakcijah obarjanja oz. redukcije ali koncentracijo bakrovih ionov v filtratu izračunajte iz enačbe umeritvene premice, Tabela 4.
Tabela 4: Rezultati po reakcijah obarjanja in redukcije
|
Obarjanje |
Redukcija |
Primerjava |
Filtrat po dodatku reagenta |
Ba(NO3)2(aq) |
NaOH(aq) |
KNO3(aq) |
Zn(s) |
Al(s) |
Cu2+(odp) |
T |
|
|
|
|
|
|
A |
|
|
|
|
|
|
c [mol/L] |
|
|
|
|
|
|
6. Najbolj učinkovita metoda je:
Preverjanje razumevanja
1. Napišite enačbe reakcij, ki so potekale pri odstranjevanju bakrovih ionov iz odpadne raztopine in nastale produkte utemeljite z uporabo podatkov v tabeli topnosti (Tabela 5) in s pomočjo elektrokemijske redoks vrste (Tabela 6).
Tabela 5: Topnost snovi v vodi
Snov |
Topnost v vodi |
Ba(NO3)2 |
79 g/L (20°C) |
BaSO4 |
netopen |
CuSO4.5H2O |
316 g/L (20°C) |
Cu(NO3)2 |
topen |
NaOH |
1,1 kg/L |
Na2SO4 |
2680 g/L |
Cu(OH)2 |
2,5 mg/L (25°C) |
KNO3 |
357 g/L |
K2SO4 |
11 g/L (20°C) |
Al2(SO4)3 |
870 g/L |
ZnSO4 |
topen |
Tabela 6: Elektrokemijska redoks vrsta
Kovina/kation |
E° (volti) |
Litij/Li+ |
-3.03 |
Kalij/K+ |
-2.92 |
Kalcij/Ca2+ |
-2.87 |
Natrij/Na+ |
-2.71 |
Magnezij/Mg2+ |
-2.37 |
Aluminij/Al3+ |
-1.66 |
Cink/Zn2+ |
-0.76 |
Železo/Fe2+ |
-0.44 |
Svinec/Pb2+ |
-0.13 |
Vodik/H+ |
0 |
Baker/Cu2+ |
+0.34 |
Srebro/Ag+ |
+0.80 |
Zlato/Au3+ |
+1.50 |
2. Katera metoda se je v vašem primeru pokazala kot najbolj učinkovita za odstranjevanje bakrovih ionov iz odpadne vode? Zakaj?
3. Kaj so prednosti in slabe strani te metode?
4. Ali bi lahko umeritveno premico, ki ste jo uporabili za določitev koncentracije bakrovih ionov v filtratu po obarjanju oz. redukciji, uporabili za odpadno raztopino bakrovih ionov poljubne koncentracije? Utemeljite svoj odgovor.
5. Razmislite, ali bi poleg navedenih načinov odstranjevanja bakrovih ionov lahko uporabili še kakšno metodo?
Vajo sta razvili in optimizirali Margareta Vrtačnik in Vida Mesec, NTF-KII |