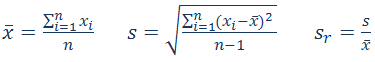|

DOLOČANJE ŽELEZA V PODTALNICI
Cilj
Določanje železovih(III) ionov v vzorcih podtalnice z uporabo spektrometrične metode.
Uvod
V zmerno kisli raztopini železovi(III) ioni reagirajo s tiocianatnimi ioni (SCN–) in nastane rdečerjavo intenzivno obarvan kompleks. Reakcija je več stopenjska, zato je v raztopini prisotnih več različnih ionov. Na primer: Fe(SCN)2+, Fe(SCN )2+ in tako naprej, pa vse do Fe(SCN)63–. Katera vrsta kompleksov prevladuje v raztopini, je odvisno od koncentracije reagentov in pH vrednosti. V razredčenih raztopinah, ki se običajno uporabljajo pri spektrometričnih analizah in pri primerljivih začetnih koncentracijah železovih(III) in tiocianatnih ionov prevladujejo Fe(SCN)2+ ioni. Povečanje molarnega razmerja med SCN– in Fe3+ ioni povzroči tvorbo kompleksov z več veznimi ligandi. Zato je pomembno, da pri spektrometrični določitvi uporabimo raztopine z enako koncentracijo tiocianatnih ionov, saj takrat dobimo najbolj primerljive rezultate. Raztopine morajo biti precej kisle (pH pod 3), da preprečimo hidrolizo železovih(III) ionov v netopen železov(III) hidroksid Fe(OH)3.
Kvantitativno določanje železa v vzorcih vode temelji na meritvah absorbance raztopin, ki jim dodamo tiocianatne ione. Na ta način lahko določimo koncentracijo železovih(III) ionov. Skupno vsebnost železa lahko določimo po oksidaciji železovih(II) ionov v železove(III) ione. Anioni, ki tvorijo stabilne komplekse z železom(III) kot so fluoridni, fosfatni, citratni ali oksalatni anioni motijo določitev s to metodo. Poleg tega vzorec ne sme vsebovati nobenih kovinskih ionov, ki s tiocianatnimi ioni dajejo obarvane komplekse, kot so kobaltovi, kromovi, molibdenovi ali titanovi ioni.
Reagenti
- Amonijev tiocianat
NH4SCN
- Dušikova(V) kislina HNO3
- Amonij železov(III) sulfat dodekahidrat
(NH4)(SO4)2 · 12H2O
Material in oprema
- Spektrometer SpektraTM
- blistri
- plastenke opremljene s kapalnimi nastavki
- merilne bučke
50 cm3
- pipete
25 cm3
Nevarnosti
|
Dušikova(V) kislina je jedka. Izogibajte se stiku s kožo in vdihavanju hlapov. R : 8-35, S: 23-26-36-45. |
|
Amonijev tiocianat je škodljiv za dihala, ob stiku s kožo in ob zaužitju.
R: 20/21/22, 32, 52/53; S: 13, 61. |
Postopek
1. Priprava standardnih raztopin
Pripravite raztopine v 50 cm3 merilnih bučkah tako, da zmešate ustrezne količine osnovne raztopine železove(III) soli s 5 cm3 raztopine amonijevega tiocianata NH4SCN (20 %) in 2 cm3 dušikove(V) kisline HNO3 (2 mol dm-3), ter dopolnite bučke z deionizirano vodo do oznake (deleži komponent so podani v spodnji tabeli).
Osnovna raztopina železove(III) soli – je vodna raztopina amonij železovega(III) sulfata dodekahidrata Fe(NH4)(SO4)2 · 12 H2O s koncentracijo 0,01 mg Fe cm-3.
VFe [cm3] |
cFe [mg cm-3]
|
VHNO3 (2M) [cm3] |
VNH4SCN (20%) [cm3] |
5 |
0,001 |
2 |
5 |
10 |
0,002 |
15 |
0,003 |
20 |
0,004 |
25 |
0,005 |
2. Izbira LED svetila
Odmerite 10 kapljic raztopine z vsebnostjo Fe 0,003 mg cm-3 v blister. Izmerite transmitanco z modrim, zelenim in rdečim LED svetilom. Izberite LED svetilo, za katerega ste dobili najnižjo prepustnost (absorbanca je najvišja). Kot slepo raztopino uporabite deionizirano vodo.
3. Merjenje prepustnosti raztopin, ki vsebujejo železove(III) ione (raztopine pripravljene pod točko 1)
Za vsako raztopino železovih(III) ionov (pet raztopin v tabeli pod točko 1, 10 kapljic vsake raztopine), opravite po tri meritve prepustnosti z izbranim LED svetilom. Vpišite izmerjene vrednosti prepustnosti v tabelo in izračunajte vrednosti absorbance (po enačbi A = -log(T/100) ali poiščite vrednosti v tabeli, ki je priloga delovnega zvezka Izkustveni pristop k spektrometriji v vidnem področju). Kot slepo raztopino uporabite deionizirano vodo.
Rezultati meritev
Raztopina št. |
cFe [mg cm-3] |
T |
A |
A (povprečna) |
1 |
0,001 |
|
|
|
|
|
|
|
2 |
0,002 |
|
|
|
|
|
|
|
3 |
0,003 |
|
|
|
|
|
|
|
4 |
0,004 |
|
|
|
|
|
|
|
5 |
0,005 |
|
|
|
|
|
|
|
4. Umeritvena premica
Uporabite podatke iz tabele pod točko 3 in narišite umeritveno premico, to je prikaz absorbance A kot funkcija koncentracije (A = f(c)). Za risanje grafa uporabite Microsoft Excel.
5. Določanje koncentracije železa(III) v vzorcu podtalnice
Odmerite 25 cm3 vzorca podtalnice v 50 cm3 merilno bučko, dodajte 5 cm3 raztopine amonijevega tiocianata NH4SCN (20 %) in 2 cm3 dušikove(V) kisline HNO3 (2 mol dm-3), ter dopolnite do oznake z deionizirano vodo. Odmerite 10 kapljic tako pripravljene raztopine v blister in izmerite prepustnost pri LED svetilu, ki ste ga izbrali pri točki 2. Kot slepo raztopino uporabite deionizirano vodo. Izračunajte povprečno vrednost absorbance.
Meritev št. |
Vzorec X |
T |
A |
A (povprečna) |
1 |
|
|
|
2 |
|
|
3 |
|
|
4 |
|
|
5 |
|
|
Izračunajte koncentracijo železovih(III) ionov v vzorcu podtalnice z uporabo naslednje enačbe:
c = 2 · A/a
a –
smerni koeficient kalibracijske premice
A –
povprečna vrednost absorbance
c –
koncentracija železovih(III) ionov v vzorcu vode, izražena v mg
cm-3
2 –
faktor redčenja
6. Določitev ponovljivosti meritev
Izračunajte relativni standardni odklon (RSD) z uporabo naslednjih enačb:
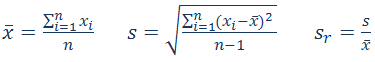
sr –
relativni standardni odklon
s –
standardni odklon
xi –
posamezni rezultat meritve
 –
povprečni rezultat meritev –
povprečni rezultat meritev
n –
število rezultatov (meritev)
Literatura
- „Chemia Analityczna.Cz. III” J. Minczewski, Z. Marczenko, PWNN, Warszawa 1985.
- „Ocena i Kontrola Jakości Wyników Analitycznych”, CEEAM, Gdańsk 2004.
Pripravila: Tomasz Chmiel, Tomasz Dymerski, Technikum Przemysłu Spożywczego i Chemicznego w Gdańsku
Pregledal: Marek Kwiatkowski, Wydział Chemii Uniwersytetu Gdańskiego
|