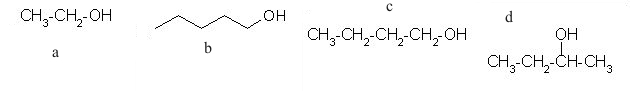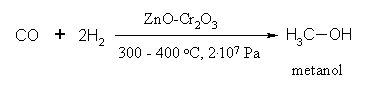Alkoholi
Alkoholi so spojine, ki imajo –OH (hidroksilno)
skupino, vezano na nasičen C atom.
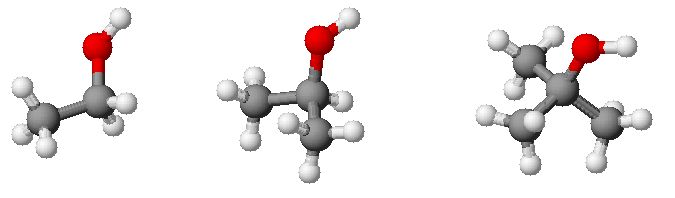
Slika 1: Primarni (etanol), sekundarni (propan-2-ol) in terciarni (2-metilpropan-2-ol) alkohol.
Pomembni predstavniki
alkoholov
metanol:
CH3-OH
etanol:
CH3-CH2-OH
propan-1-ol: CH3-CH2-CH2-OH
propan-2-ol:
CH3-CH(OH)-CH3
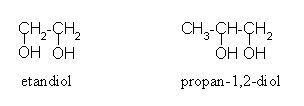
etan-1,2-diol:
HO-CH2-CH2-OH
propan-1,2-diol:
CH3-CH(OH)-CH2(OH)
propan-1,2,3-triol:
HO-CH2-CH(OH)-CH2-OH
1. Med spodnjimi alkoholi najdi primarne alkohole. Črke za posamezne primarne alkohole vpišite v spodnjo tabelo (črke si naj sledijo po abecedi).
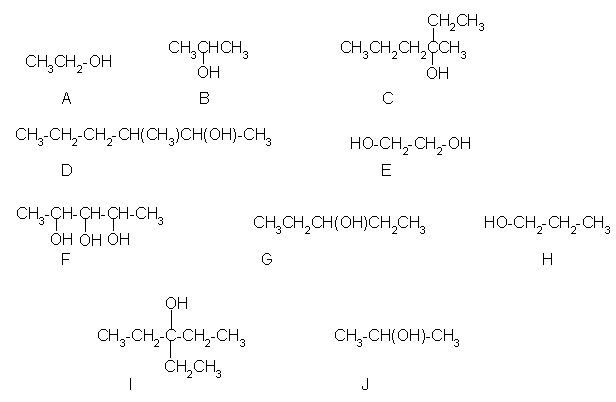
| vrsta alkohola |
črka |
| primarni |
,
,
|
| sekundarni |
,
,
,
,
|
| terciarni |
,
|
2. Zgornje alkohole razvrsti v naslednjo skupino (črke si naj sledijo po abecedi).
| vrsta alkohola |
črka |
| monohidroksi |
,
,
,
,
,
,
,
|
| dihidroksi |
|
| trihidroksi |
|
Vrelišče
Temperatura vrelišča
narašča z naraščajočim številom ogljikovih atomov v molekuli.
Polihidroksi alkoholi
imajo bistveno višje temperature vrelišča kot monohidroksi alkoholi z enakim
številom ogljikovih atomov. Vrelišče alkoholov z
razvejanostjo skeleta pada.
Tabela 1: Odvisnost vrelišča od števila ogljikovih atomov.
| alkohol | Tv[°C] |
| metanol |
65 |
| etanol |
78 |
| propanol |
97 |
Tabela 2: Odvisnost vreliša od števila -OH skupin.
| alkohol | Tv[°C] |
| propan-1-ol |
97 |
| propan-1,2-diol |
188 |
| proapn-1,2,3-triol |
290 |
Tabela 3: Odvisnost vrelišča od razvejanosti skeleta.
| alkohol |
Tv[°C] |
| butan-1-ol |
117 |
| 2-metilpropan-1-ol |
108 |
| 2-metilpropan-2-ol | 82 |
Topnost v vodi
Nižji monohidroksi
alkoholi se raztaplajo v vodi v vseh razmerjih. Ko se veriga podaljša na več
kot 3 C-atome, postanejo monohidraksi alkoholi netopni v vodi. K boljši topnosti
prispeva večje število -OH skupin. Razlog najdemo v nastanku vodikovih vezi. Vodikove vezi nastanejo med molekulami vode in molekulami alkohola, kar omogoča topnost
manjših molekul alkohola v vodi. Z daljšanjem C-verige postajajo alkoholi vse bolj
podobni alkanom (nepolarni del prevlada), zato so netopni v vodi.

Slika 2: Molekule alkohola se lahko z vodikovmi vezmi vežejo z molekulami vode.
Tabela 4: Topnosti alkoholov v odvisnosti od dolžine verige v molekuli.
| alkohol |
topnost v g/100 g vode |
| metanol |
topen |
| etanol |
topen |
| propan-1-ol |
topen |
| butan-1-ol | 8 |
| pentan-1-ol |
2 |
|
Vrelišče alkoholov enakomerno narašča s številom
C-atomov.
| |
|
Topnost alkoholov narašča s številom C-atomov.
| |
|
Topnost alkoholov je neodvisna od števila OH skupin.
| |
|
Med molekulami vode in molekulami alkohola se
tvorijo disperzijske vezi.
|
1. Nukleofilna substitucija na halogenalkanih v vodnih raztopinah NaOH ali KOH.
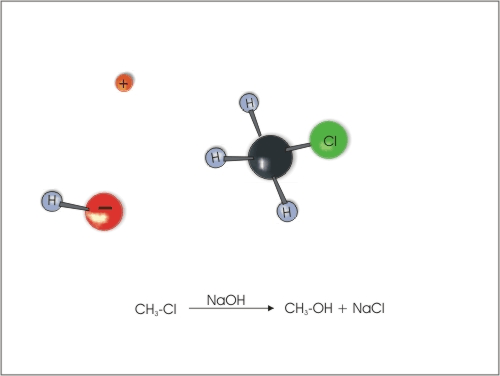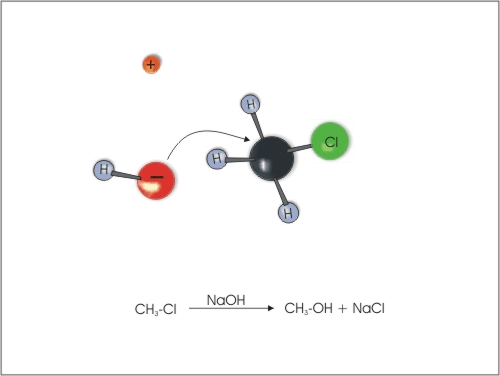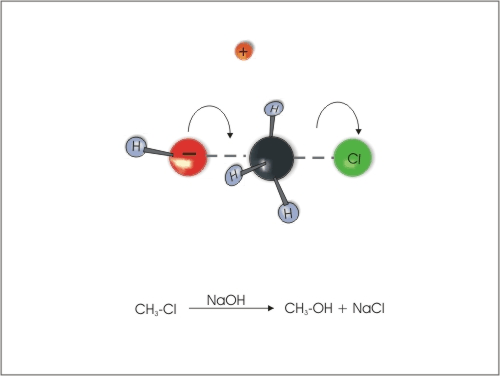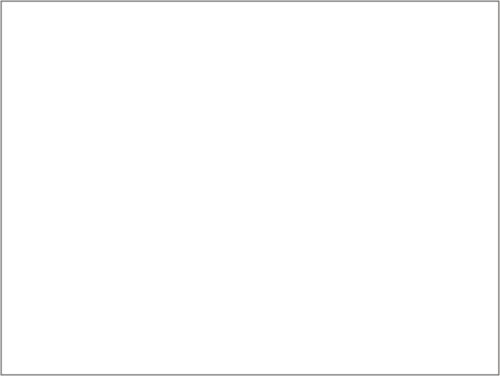
Slika 3: Zamenjava klora z -OH skupino.
2. Redukcija aldehidov, ketonov in karboksilnih kislin. Z redukcijo aldehidov in karboksilnih kislin nastanejo primarni alkoholi, z redukcijo ketonov pa sekundarni alkoholi.
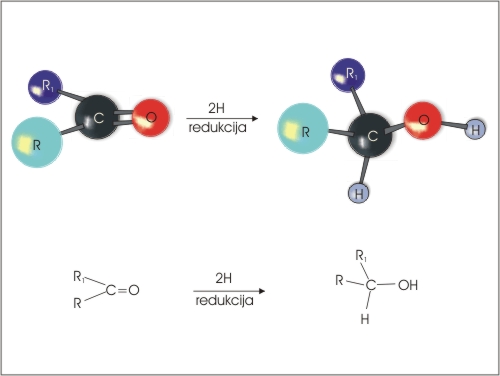
Slika 4: Redukcija karbonilne skupine do alkohola.
3. Kislinsko katalizirana adicija vode na alkene. Pri tem je potrebno upoštevati Markovnikovo pravilo (vodikov atom se veže na tisti ogljikov atom, ki ima vezanih več vodikovih atomov).
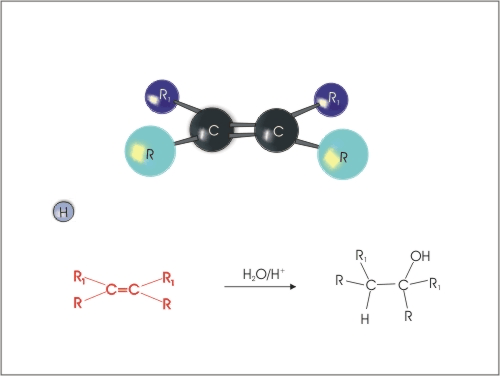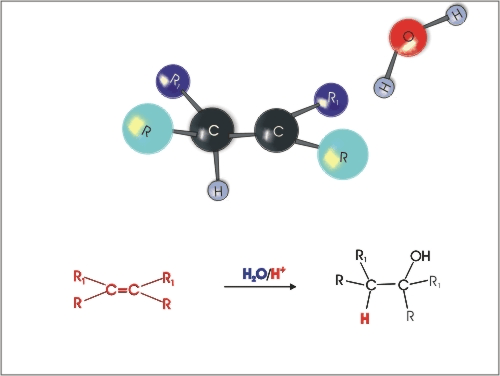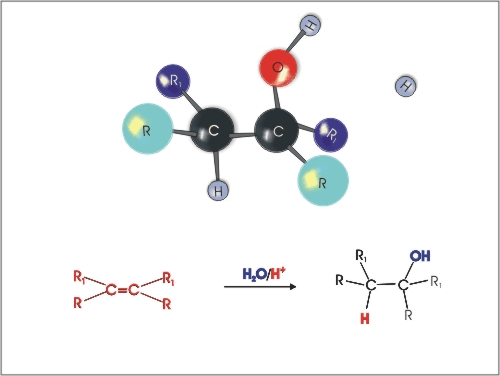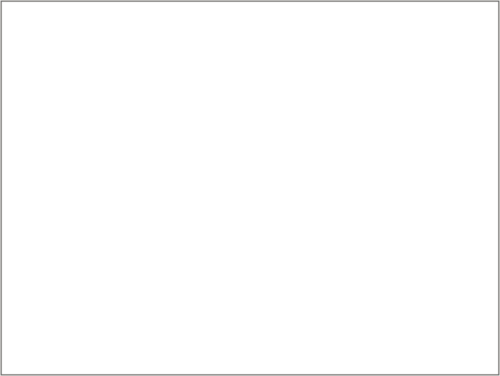
Slika 5: Kislinsko katalizirana adicija vode na alken.
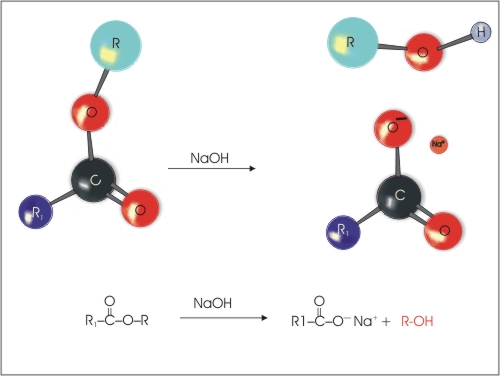
4. Hidroliza estrov, ki poteče pod vplivom kisline ali baze. Pri bazični hidrolizi poleg alkohola nastane sol karboksilne kisline in ne kislina kot to pri kislinski hidrolizi estrov.
5. Alkoholno vrenje. Pretvorba
sladkorja v etanol in ogljikov dioksid s pomočjo gliv kvasovk.
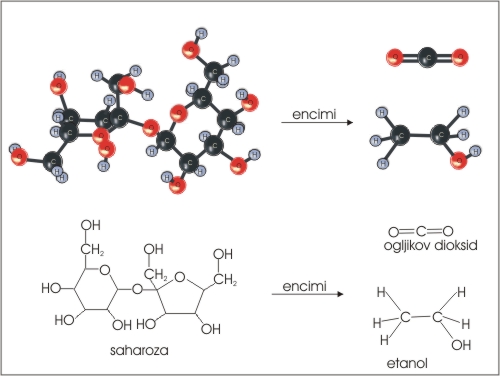
Slika 7: Pri alkoholnem vrenju nastane etanol in ogljikov dioksid.
6. Sinteza metanola iz ogljikovega oksida in vodika, ki jo poznamo tudi kot Fischer-Tropschova sinteza, poteka izključno industrijsko.
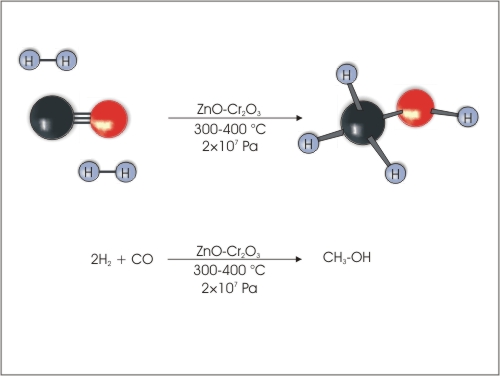
Slika 8: Fischer-Tropschova sinteza metanola iz vodika in ogljikovega oksida.
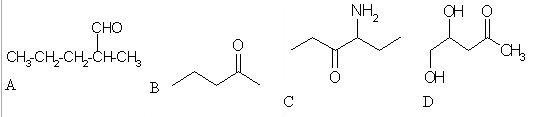
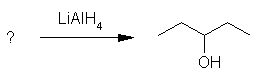
4. Ugotovi spojino iz katere je nastal alkohol pri spodnji reakciji.
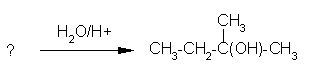
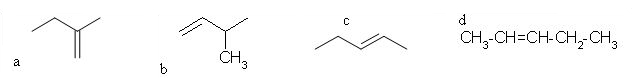
črka:
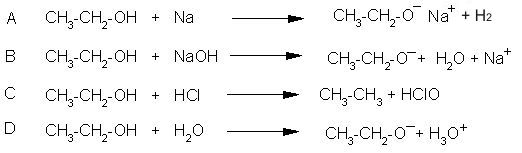
Alkoholi lahko reagirajo kislo in bazično. Alkoholi v primerjavi z vodo težje oddajajo vodikov ion, so torej šibkejše kisline kot voda (slika 9a). Alkoholm vodik lažje odvzamejo alkalijske kovine pri čemer nastanejo alkoksidi (slika 9b). Bazične lastnosti alkoholov in vode so pa podobne. V kislih raztopinah se alkoholi protonirajo (Slika 9c).
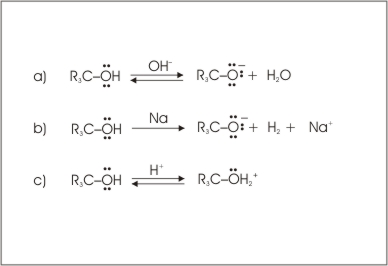
Slika 9: Reakcije alkoholov v kislem (a), z natrijem (b) in v bazičnem (c).
Alkoholi reagirajo z natrijem podobno kot voda, a manj burno. Pri reakciji vode z natrijem dobimo vodik in natrijev hidroksid, pri reakciji etanola z natrijem dobimo vodik in natrijev etoksid. Natrijev hidroksid v vodi reagira bazično, zato se indikator fenolftalein obarva vijolično. Poglejmo si obe reakciji na spodnjem filmu in ugotovio obarvanje fenolftaleina v raztopii natrijevega etoksida.
Film 1: Reakcija natrija z vodo in z alkoholom v prisotnosti indikatorja fenolftalein.
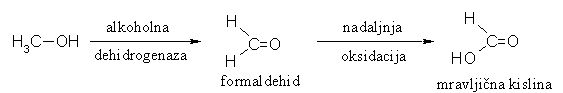
2. Redoks reakcije
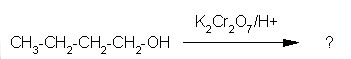
Z oksidanti, kot sta KMnO4 in K2Cr2O7, zlasti v kislih raztopinah se primarni alkoholi oksidirajo v aldehide, ki se najprej oksidirajo v karboksilne kisline. Sekundarni alkoholi se oksidirajo v ketone, medtem ko se terciarni alkoholi ne oksidirajo.
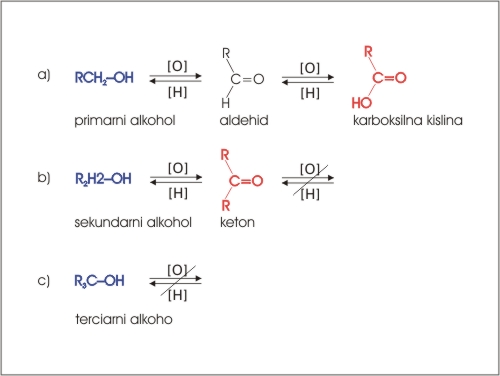
Slika 10: Oksidacija primarnih (a) in sekundarnih (b) alkoholov. Terciarni alkoholi se ne oksidirajo (c).
Reakcijo oksidacije alkohola s kalijevim dikromatom so včasih uporabljali kot alkotest. V prisotnosti etanola se kalijev dikromat, ki je oranžne barve, reducira do kromovih Cr3+ ionov, ki je zelene barve. Čim več etanola je prisotnega v izdihanem zraku, tem več Cr3+ ionov nastane in bolj intenzivne zelene barve je raztopina. Po jakosti zelenega obarvanja raztopine so določili vinjenost voznika, ki je določena z mejo 0,5 promila.
3 C2H5OH + 2 Cr2O72-
+ 16 H+ → 3 CH3COOH + 4 Cr3+ + 11 H2O
Film 2: Alkotest (etanol + K2Cr2O7/H+).
5. Ena od reakcij dejansko poteče. Katera?
6. Ugotovi pravilni produkt naslednje reakcije.
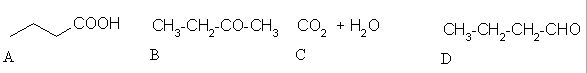
črka:
7. Ugotovi pravilni produkt naslednje reakcije.
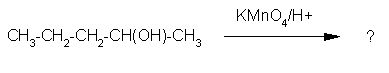
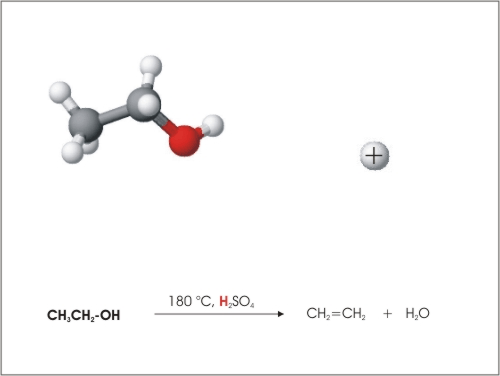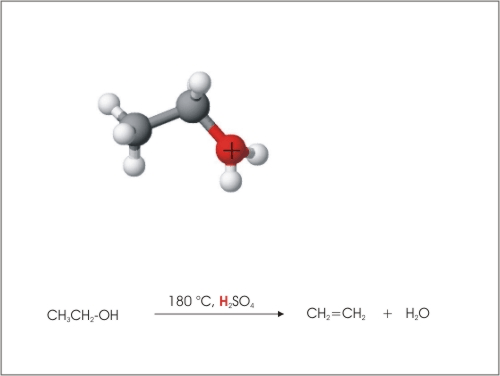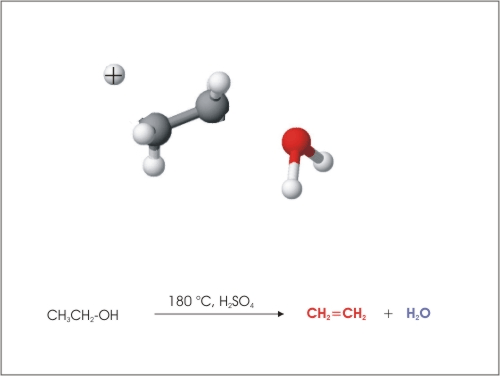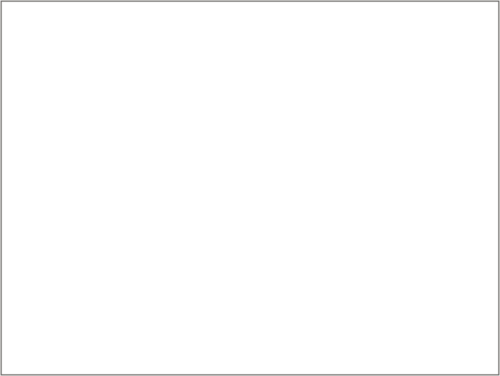
3. Eliminacija vode
Iz molekul etanola se lahko odcepijo molekule vode pri povišani temperaturi (180 °C) in s pomočjo katalizatorja, ki je H2SO4 ali Al2O3.
Molekule vode se odcepijo iz dveh molekul alkoholov. Pri temperaturi 140°C in ob prisotnosti
kisline kot katalizatorja nastanejo etri.
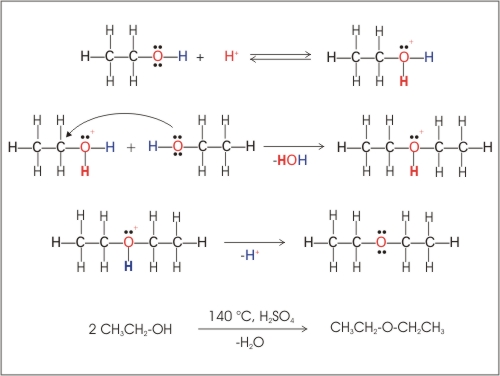
Slika 11: Nastanek dietil etra (etoksi etan) iz etanola.
4. Substitucija ali zamenjava -OH skupine z atomi halogenov. Alkoholi reagirajo s halogenvodikovimi kislinami (HCl, HBr in HI), pri čemer nastane ustrezen haloalkan in voda. Reaktivnost alkoholov pada v naslednjem zaporedju: terciarni alkohol > sekundarni alkohol > primarni alkohol. Reaktivnost halogenvodikovih kislin pa pada v zaporedju: HI > HBr> HCl.
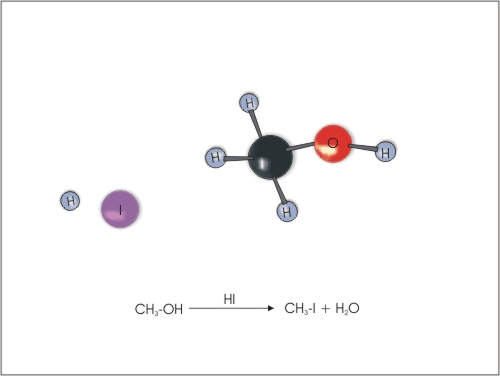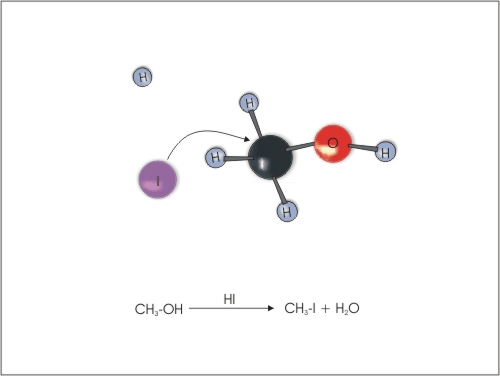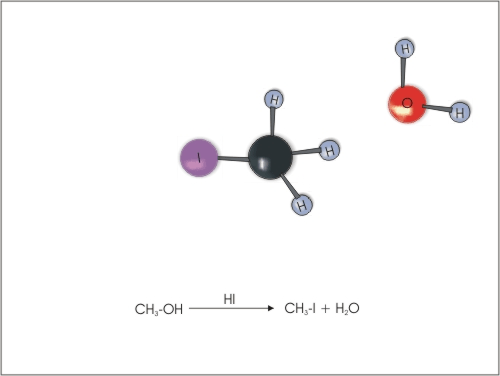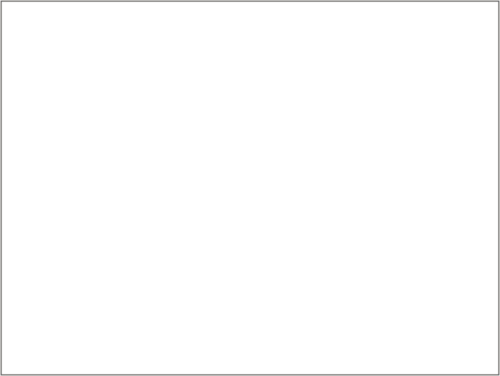
Slika 12: Zamenjava OH skupine v alkoholu z atomom joda.
5. Gorenje
Podobno kot ogljikovodiki tudi alkoholi na zraku pri popolnem gorenju zgorijo do CO2 in H2O. Etanol se uporablja kot gorivo pri avtomobilih.
![]()

Slika 13: Etanol lahko uporabljamo kot pogonsko gorivo.
8. Ugotovi možen produkt naslednje reakcije.
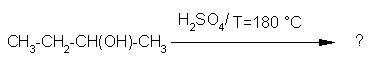
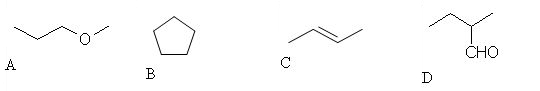
9. Iz katere spojine je nastal alkohol pri spodnji reakciji.
10. Kateri alkohol nastane pri hidrolizi butil etanoata?