Titracija
V tem gradivu bomo spoznali postopek titracije s katerim določamo množino kisline ali baze v raztopini. Spoznali bomo vlogo indikatorjev in pomen izbire ustreznega indikatorja.
Titracija je kvantitativna volumetrična analizna metoda za količinsko določanje znanih snovi. Kadar so te snovi kisline ali baze,
govorimo o kislinsko-baznih ali tudi nevtralizacijskih titracijah. Za
titracijo potrebujemo:
pipeto - za odmero natančne prostornine vzorca (kisline ali baze),
erlenmajerico - v katero odpipetiramo vzorec,
bireto - za dodajanje oz nevtraliziranje vzorca s standardno raztopino
(baze ali kisline), to je raztopine katere koncentracijo natančno
poznamo,
indikator - ki nam pokaže ekvivalentno točko, to je tisto prostornino standardne raztopine, ki nevtralizira naš vzorec. V
ekvivalentni točki se barva indikatorja spremeni.

Slika 1. Titracija raztopine NaOH z raztopino HCl ob lakmusu kot indikatorju.
So največkrat organske molekule, ki so v kislem drugače obarvane kot v bazičnem mediju. Ker jih lahko uporabljamo kot pokazatelje kislosti oz. bazičnosti, jim pravimo kislinsko bazni indikatorji. Ti indikatorji so največkrat šibke organske kisline ali baze, za katere lahko zapišemo reakcijo:
| HIn |
+ | H2O |
H3O+ |
+ | In− |
|
| barva 1 |
barva 2 |
V odvisnosti od koncentracije oksonijevih ionov v raztopini je ravnotežje zgornje reakcije pomaknjeno v smeri molekul nedisociirane kisline HIn (barva 1) ali pa v smeri disociiranih ionov In− (barva 2).
Tako kot se vse kisline razlikujejo v konstanti kisline, to velja tudi za kislinsko bazne indikatorje. To pomeni, da je za vsak indikator značilno, da je prehod ene barve v drugo barvo pri drugačni koncentraciji oksonijevih ionov oz. pri drugačnem pH. Tako je za lakmus kot za najbolj znan indikator značilna rdeča barva pod pH 4,5 in modra nad pH 8,2. Prehod barve indikatorja iz ene v drugo barvo imenujemo interval indikatorja. Na Sliki 2 je navedenih nekaj najbolj znanih kislinsko baznih indikatorjev z značilnimi barvami in prehodi.
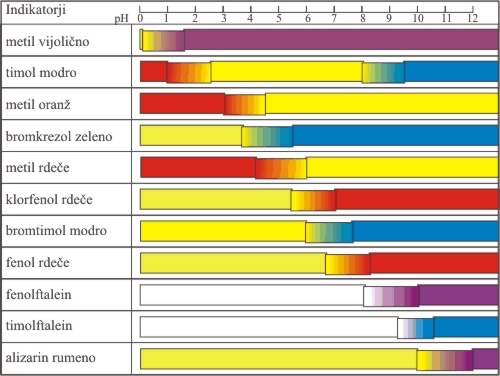
Slika 2. Indikatorji in njihov prehod v odvisnosti od pH.
Kot indikatorji se lahko uporabljajo tudi naravna barvila, npr. sok rdečega zelja (slika 3).

Slika 3. Obarvanje ekstrakta rdečega zelja pri različnih vrednostih pH (foto: B. Vidrih).
Ker različni indikatorji spremenijo barvo pri različnem pH, lahko s kombinacijo več indikatorjev dobimo t. i. univerzalni indikator za merjenje pH (slika 4).

Slika 4. Univerzalni indikator (kombinacija štirih indikatorjev).
Titracijska krivulja nam kaže spremembo pH v odvisnosti od prostornine dodane baze h kislini ali obratno. Pove nam, da je v trenutku nevtralizacije sprememba pH največja. Pri tej spremembi pH se spremeni barva indikatorja - ekvivalentna točka. Na sliki 5 je primer titracijske krivulje, ki jo dobimo pri titraciji močne kisline (HCl) z močno bazo (NaOH). Pri nevtralizaciji nastane sol, to je NaCl, zato je pH v strmem delu krivulje enak 7.
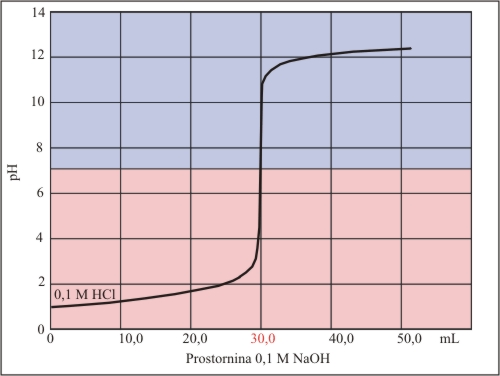
Slika 5. Značilna titraciijska krivulja pri titraciji močne kisline z močno bazo.
Sol, ki nastane pri titraciji šibke kisline in močne baze pa ni nevtralna, reagira bazično. Pri takšnih titacijah je izbira indikatorja izredno pomembna. Na spodnjih dveh animacijah poglejmo kaj se nam lahko zgodi pri napačni izbiri indikatorja:
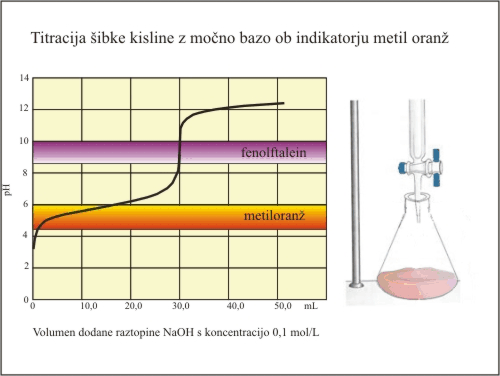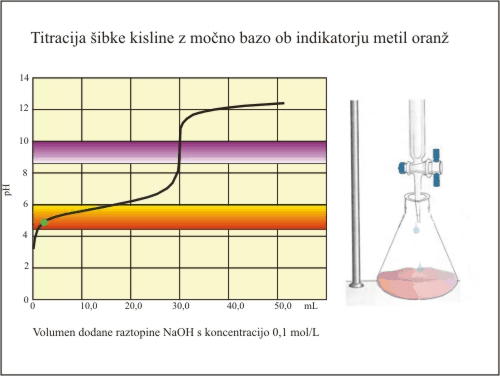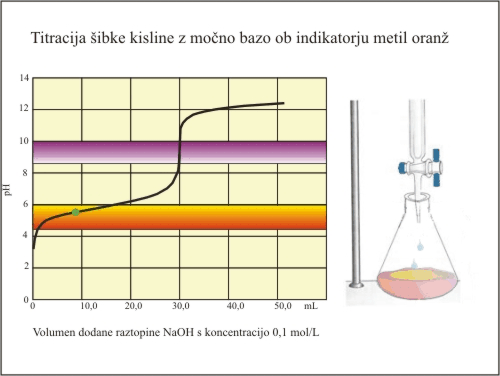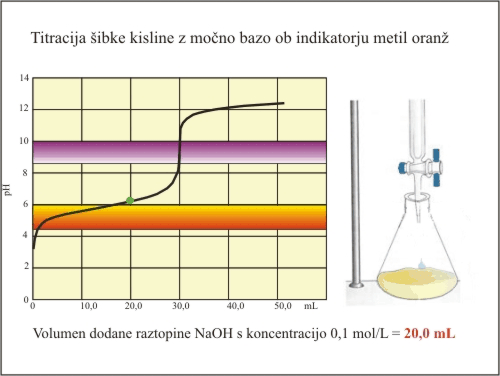
Slika 6. Titracija šibke kisline (metiloanž).
Metiloranž spremeni barvo v območju pH, ki je zunaj strmega dela titracijske krivulje. Spremembo barve dosežemo ko kislina še ni vsa nevtralizirana. Izmerimo manjši volumen potrebne baze za nevtralizacijo (20 mL) in kasneje izračunamo nižjo koncentracijo kisline.
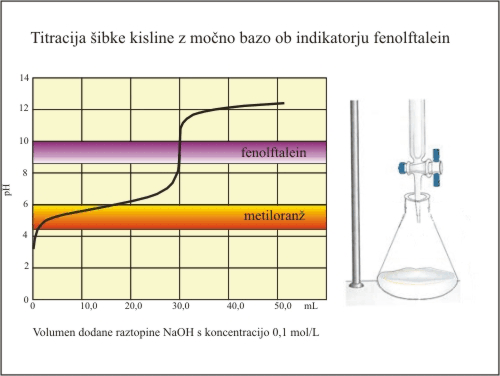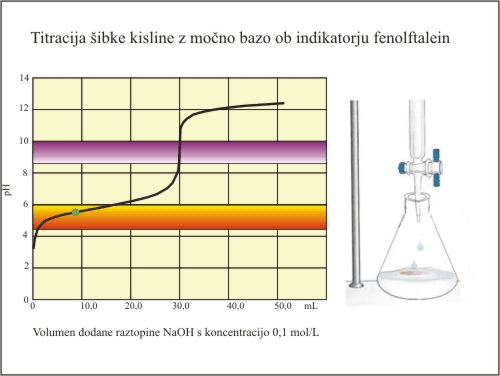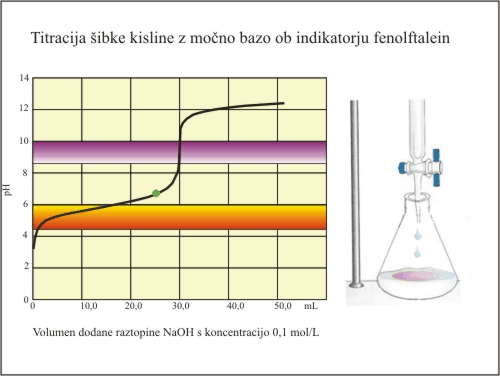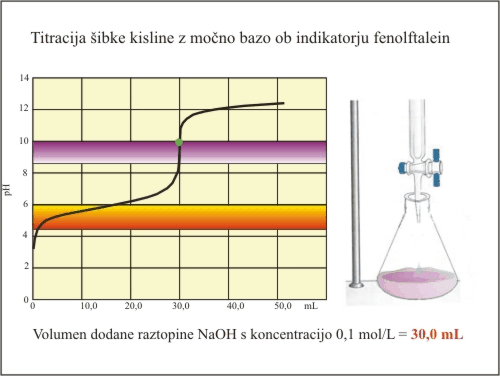
Slika 7. Titracija šibke kisline (fenolftalein).
Fenolftalein ima svoj barvni prehod v strmem delu titracijske krivulje. Nevtralizacijo dosežemo prav v trenutku, ko se fenolftalein obarva. Ekvivalentno točko tako določimo pri prostornini baze 30 mL. V tem primeru lahko izračunamo natančno koncentracijo kisline.
Podoben problem imamo pri titraciji šibke baze z močno kilino.
S pravilno izbiro indikatorja in s spremembo njegove barve pri titraciji ugotovimo prostornino baze (ali kisline), ki je potreben za popolno nevtralizacijo kisline (ali baze). Osnova vsake titracije je kemijska reakcija med znano kislino in bazo. Iz razmerja množin in z znanimi prostorninami in koncentracijo ene izmed snovi lahko izračunamo koncentracijo vzorca.
Z 0,100 M HCl smo nevtralizirali 20,0 mL NaOH, pri tem smo porabili 15,5 mL kisline. Izračunajmo koncentracijo baze.
Reakcija: NaOH + HCl → NaOH + H2O
Vidimo, da je n(NaOH) = n(HCl).
V zgornji enačbi lahko množino zamenjamo s koncentracijo in prostornino: n = cV:
c(NaOH)V(NaOH) = c(HCl)V(HCl)
c(NaOH) = (c(HCl)V(HCl))/V(NaOH) = (0,100 mol/L x 20,0 mL)/15,5 ml = 0,129 mol/L
|
5 mL
| |
|
10 mL
| |
|
20 mL
| |
|
30 mL
|
| kis | |
| limona | |
| pralni prašek |
|
| coca cola |
|
| milo | |
| vino |
|
75,0 mL
| |
|
37,5 mL
| |
|
18,8 mL
| |
|
10,0 mL
|
|
0,30 g
| |
|
0,60 g
| |
|
1,20 g
| |
|
2,40 g
|
