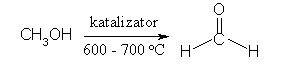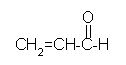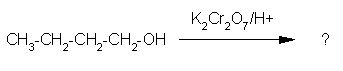Aldehidi in ketoni
Strukturne lastnosti aldehidov in ketonov
Aldehidi so spojine, ki vsebujejo -C=O (karbonilno) skupino na koncu verige, posledično je na to skupino vezan še vodik, zato je značilna skupina za aldehide -CHO skupina.
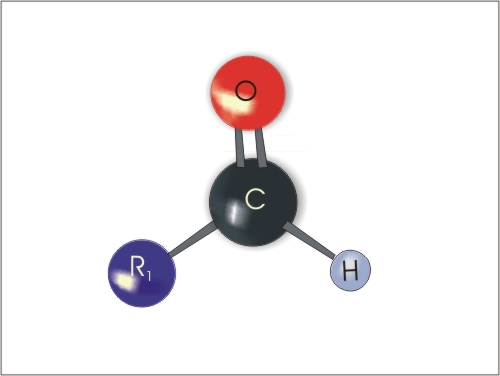
Slika 1. struktura aldehida
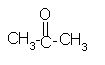
Ketoni so spojine, ki vsebujejo -C=O (karbonilno) skupino znotraj verige ogljikovih atomov. Tako je na ogljik karbonilne skupine na obeh straneh vezana alkilna ali arilna skupina. Značilna skupina je torej -C=O.
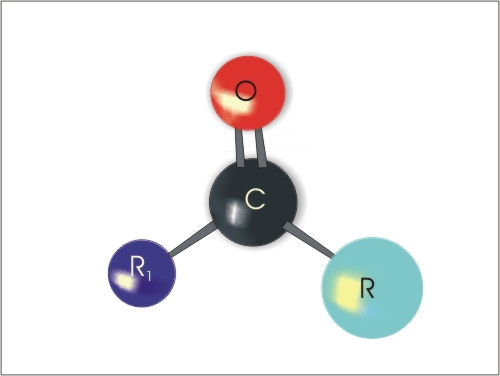
Slika 2. Struktura ketona
Pomembni predstavniki aldehidov in ketonov:
metanal,
H-CHO
etanal,
CH3-CHO
propanal,
CH3-CH2-CHO
propenal,
CH2=CH-CHO
propanon,
CH3-CO-CH3
butanon,
CH3-CO-CH2-CH3
Aldehida z enim in dvema ogljikovima atomoma sta pri sobni temperaturi plina. Aldehidi s tremi do enajst ogljikovih atomov so tekočine, aldehidi s še večjim številom ogljikovih atomov so trdni. Nižji ketoni so tekočine pri sobni temperaturi. Vrelišča aldehidov in ketonov so višja od vrelišč alkanov in nižja od vrelišč alkoholov pri podobni molski masi (tabela 1). Aldehidi in ketoni imajo višje temperature vrelišč kot alkani zaradi dipol-dipol vezi med molekulami, ki so posledica dipolnega momenta karbonilne skupine. Aldehidi in ketoni imajo nižje temperature vrelišča kot alkoholi, ker ne tvorijo vodikove vezi.
Tabela 1: Vrelišča aldehidov primerjalno z alkani in alkoholi.
| tip spojine | spojina | formula |
molska masa
[g/mol] |
Tv
[°C] |
| alkan aldehid alkohol |
etan metanal metanol |
CH3CH3 HCHO CH3OH |
30 30 32 |
-89 -21 65 |
| alkan aldehid alkohol |
propan etanal etanol |
CH3CH2CH3 CH3CHO CH3CH2OH |
44 44 46 |
-42 20 78 |
| alkan aldehid alkohol |
butan propanal propan-1-ol |
CH3CH2CH2CH3 CH3CH2CHO CH3CH2CH2OH |
58 58 60 |
-1 49 97 |
Topnost v vodi
Molekule vode lahko tvorijo vodikove vezi z aldehidi in ketoni, tako so aldehidi in ketoni z manjšim številom ogljikovih atomov topni v vodi. Z večanjem molske mase topnost aldehidov in ketonov v vodi pada (podobno kot pri alkoholih).
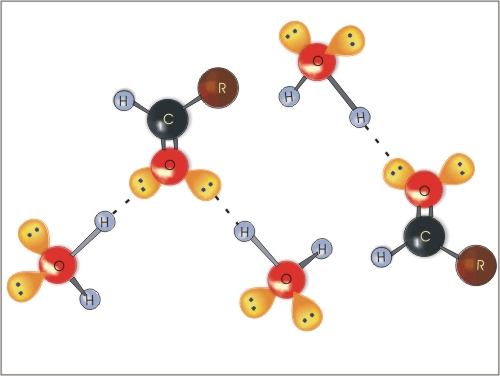
Slika 5: Tvorba vodikovih vezi med molekulami vode in molekulami aldehida
Tabela 2: Topnost nekaterih aldehidov in ketonov v vodi.
| spojina | formula | molska masa [g/mol] |
topnost [g/100g] |
| metanal etanal propanal butanal pentanal |
HCHO CH3CHO CH3CH2CHO CH3CH2CH2CHO CH3CH2CH2CH2CHO |
30 44 58 72 86 |
popolnoma popolnoma 16 7 malo |
| propanon butanon pentan-2-on |
CH3COCH3 CH3COCH2CH3 CH3COCH2CH2CH3 |
58 72 86 |
popolnoma 26 6 |
Aldehide sintetiziramo iz primarnih alkoholov, ketone pa iz sekundarnih alkoholov z oksidanti kot sta KMnO4 in K2Cr2O7.
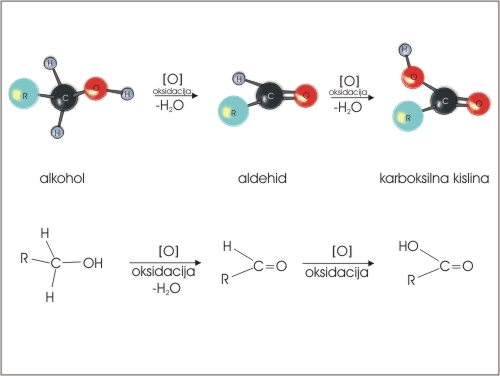
Slika 6: Oksidacija primarnega alkohola.
Pri reakciji moramo kontrolirati pogoje, da ne poteče oksidacija do karboksilne kisline.
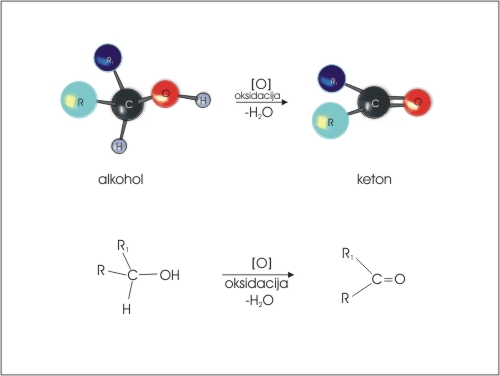
Slika 7: Oksidacija sekundarnega alkohola.
2. Redukcija karboksilnih kislin
Z redukcijo karboksilnih kislin lahko nastanejo aldehidi ne pa tudi ketoni.
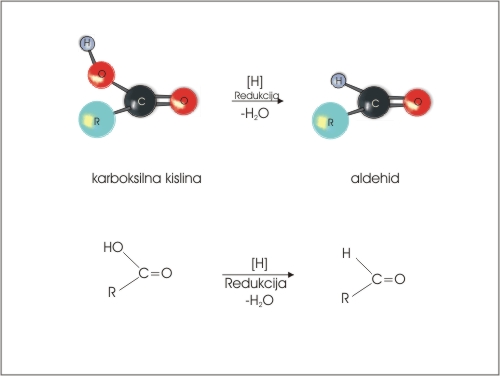
Slika 8 Redukcija karboksilne kisline
3. Aciliranje aromatski spojin (Fridel Craftsova reakcija)
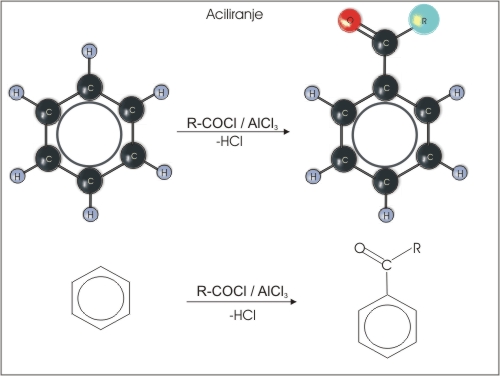
Slika 9: Nastanek ketona pri aciliranju.
4. Adicija vode na alkine
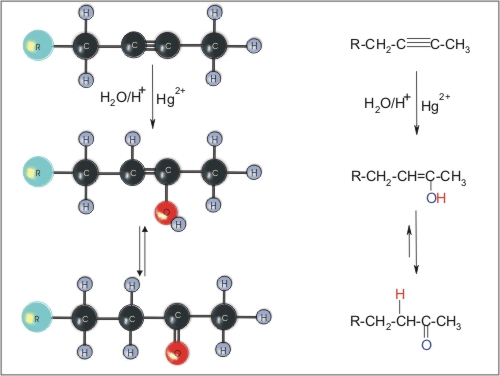
Slika 10: Kislinsko katalizirana adicija vode na alkin.
Reaktivno mesto aldehidov in ketonov je karbonilna skupina s prebitkom elektronov na kisiku in s primanjkljajem elektronov na ogljiku. Ker sta kisik in ogljik povezana z dvojno vezjo, so za te spojine značilne nukleofilne adicije. Ker je molekula ob reaktivnem mestu planarna, lahko reaktant napade karbonilno skupino od zgoraj ali od spodaj. Nukleofil se lažje veže na ogljik karbonilne skupine, če je nanj vezan vodik, tako so nukleofilne reakcije hitrejše na aldehide, zato so aldehidi bolj reaktivni. Pri adiciji se planarna struktura aldehida ali ketona spremeni v tetraedrično:
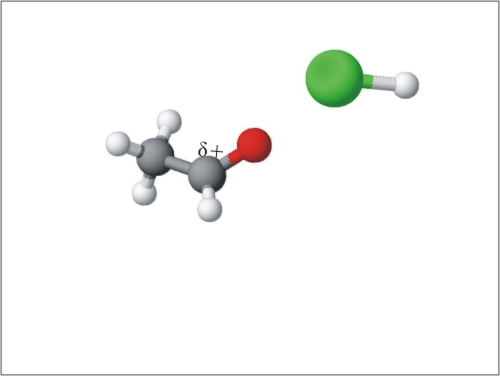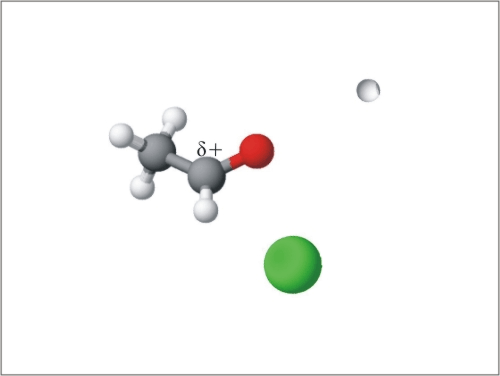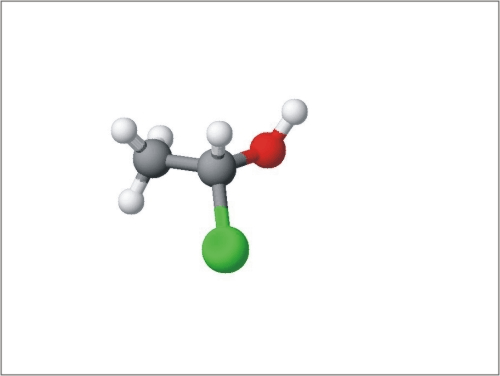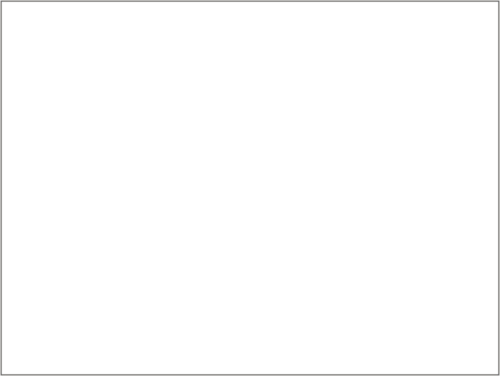
Slika 11: Animacija nukleofilne adicije na aldehide in ketone.
1. Nukleoflne adicijeADICIJA VODIKA na aldehide in ketone je dejansko redukcija, ki poteka v laboratoriju s spojinami, ki so vir vodika, kot sta: LiAlH4 ali NaBH4. V industrijskih procesih pa poteka reakcija z vodikom v prisotnosti katalizatorja (Ni, Pt, Cu). Adicija vodika na aldehide vodi do nastanka primarnih alkoholov, adicija vodika na ketone pa do nastanka sekundarnih alkoholov.
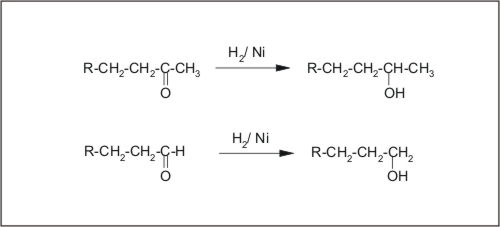
Slika 12: Redukcija aldehidov in ketonov.
Adicija na aldehide in ketone je zelo podobna adiciji vodika na dvojno vez v alkenih.
ADICIJA HCN je pomembna reakcija, ker na ta način v molekulo vežemo nov ogljikov atoma in tako lahko podaljšujemo verigo molekule.
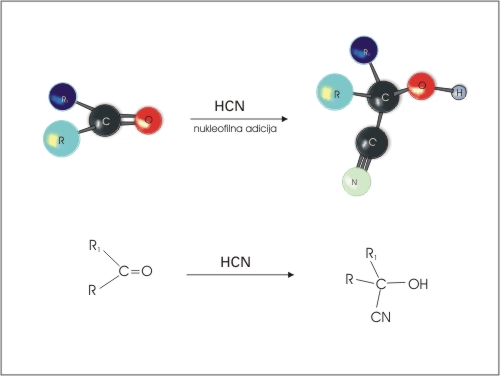
Slika 13: Adicija HCN na keton.
ADICIJA DERIVATOV AMONIAKA
Značilnos amonijaka in njegovih derivatov je prosti elektronski par, zato se te molekule obnašajo kot nukleofili in sodelujejo pri nukleofilnih reakcijah.
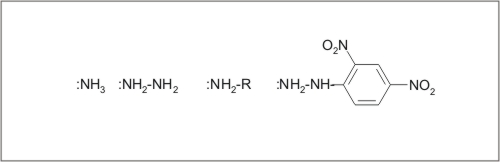
Slika 14: Amonijak in derivati.
Derivati so spojine, ki nastanejo iz osnovnih spojin ali so podobne tem spojinam. Nukleofilno adicijo 2,4-dinitrofenilhidrazina uporabljamo tudi kot dokaz za karbonilno skupino. Pri reakciji nastanejo rumeno-oranžni kristalinični hidrazoni:

Slika 15: Adicija 2,4-dinitrofenilhidrazina na aldehid - dokaz -C=O skupine.
2. Oksidacije aldehidov do karboksilnih kislin
Aldehidi se zlahka oksidirajo do karboksilnih kislin, ketoni pa ne. Aldehidi se oksidirajo v karboksilne kisline tudi s pomočjo kisika v zraku. Kadar aldehid sintetiziramo z oksidacijo, ga je potrebno takoj odstraniti iz sistema, da preprečimo nadaljnjo oksidacijo.
Za oksidacijo ketonov bi bilo potrebno pretrgati C-C vez, ki je precej močnejša od C-H vezi, kar lahko dosežemo z močnejšimi oksidanti in ostrejšimi pogoji.
Oksidacija je reakcija, ki jo uporabljamo za razlikovanje med aldehidi in ketoni. V ta namen uporabljamo:
- Tollensov reagent
- Fehlingov reagent
Oba reagenta vsebujeta šibke oksidante. Pri Tollensovi reakciji nastaja srebrovo zrcalo, reagent pa vsebuje srebrov nitrat AgNO3 in amoniak NH3 v vodi. Ko reagirajo Ag+ ioni z aldehidom, se le-ta reducira do elementarnega srebra Ag, ki se nalaga na stene epruvete (srebrovo zrcalo). Tollensova reakcija s ketoni ne poteče!
Pri Fehlingovem testu za oksidacijo uporabimo Cu2+ ione, ki se reducirajo do Cu+ ionov, ki se iz raztopine obarjajo v obliki Cu2O (rdeča oborina). Fehlingov reagent pripravimo z raztapljanjem bakrovega sulfata, natrijevega tartrata in natrijevega hidroksida v vodi.
Slika 16: Pozitivna Fehlingova reakcija na aldehid.
Karbonilne skupine, ki vsebujejo acetilno skupino (CH3CO-; acetaldehid, metil alkil ketoni, ne pa tudi ocetna kislina), dajejo z jodom v alkalnem mediju - jodoformsko reakcijo.
To je zanimiv primer oksidacije metil ketonov, povezane s pretrganjem vezi C-C. Reakcija halogeniranja metil ketonov, pri katerih nastanejo molekule karboksilne kisline (v bazičnih pogojih karboksilatni ioni) in molekule trihalometana (haloforma - npr. trijodometan je viden kot rumena oborina), je katalizirana z močnimi kislinami oziroma z močnimi bazami.
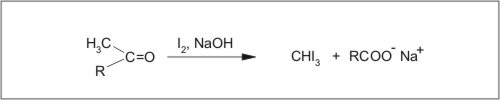
Slika 17: Jodoformna reakcija
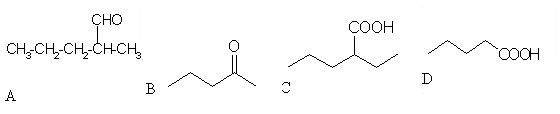
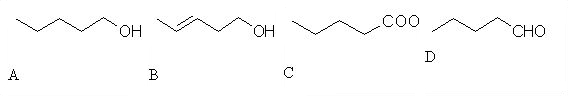
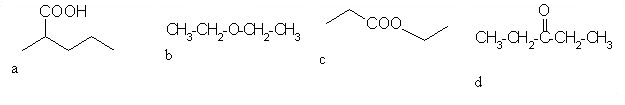
1. Med spodnjimi spojinami razlikuj med aldehidi in ketoni. Črke za posamezne spojine vpišite v spodnjo tabelo (črke pišite po abecednem vrsten redu).
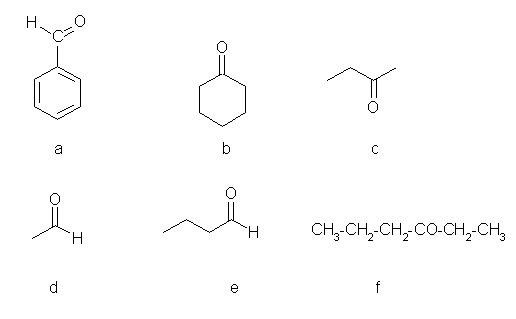
| spojina | črka |
| aldehid |
,
,
|
| keton |
,
,
|
3. Izberi črko pod pravim produktom naslednje reakcije.
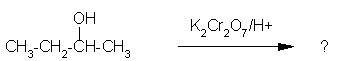
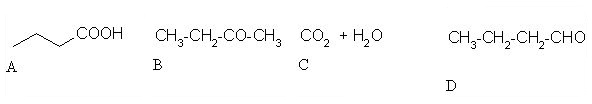
Črka:
4. Ugotovi pravilni produkt naslednje reakcije.
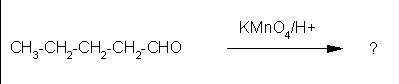
Črka:
5. Ugotovi možen produkt naslednje reakcije.

Črka:
6. Ugotovi, katera spojina nastane pri spodnji reakciji.
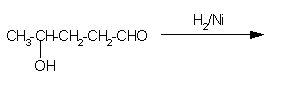
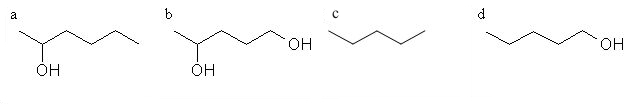
Črka:
7. Ugotovi spojino, iz katere je nastal alkohol pri spodnji reakciji.
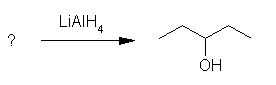
Črka:
8. Katera od reakcij
dejansko poteče?
|
| |
|
| |

| |
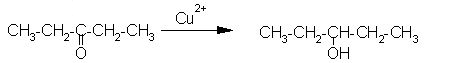
|
10. Ugotovi spojini A in B?
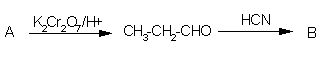
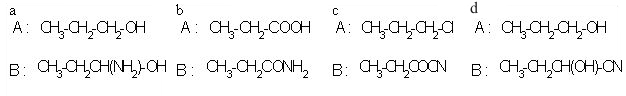
Črka: