Amini so organske baze
Spoznali boste, da so organski amini sorodniki amonijaka.
Zvedeli boste, zakaj imajo amini bazične lastnosti.
Spoznali boste delitev organskih aminov in osnove poimenovanja.
Zvedeli boste, kaj so alkaloidi in zakaj so nevarni.
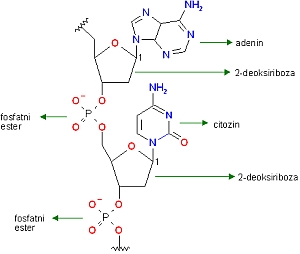
Zvedeli boste, da med amine uvrščamo tudi organske baze, gradnike makromolekule DNA.
Amini so dušikove organske spojine, analogi amonijaka, kar pomeni, da so strukturno sorodni amonijaku.
Poglejte poskus, dokaz dušika v beljakovini las.
|
|
Lasje so v vodi netopne beljakovine. Pramen las damo v vodno raztopino natrijevega hidroksida in segrevamo. Poteče bazična hidroliza beljakovine las, sprošča se amonijak, ki ga dokažemo z rdečim vlažnim lakmusovim papirčkom. Papirček držimo nad ustjem erlenmajerice in opazujemo spremembo barve lakmusovega papirčka. |
NH3 + H2O ↔ NH4+ +
Rdeči lakmusov papirček je , ker so pri raztapljanju amonijaka v vodi (vlažen lakmusov papirček) nastali ioni.
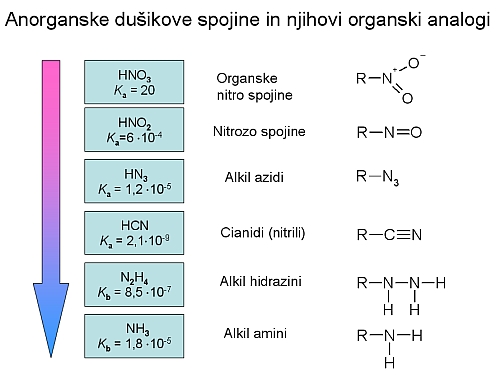
Organske dušikove spojine izpeljemo iz njihovih anorganskih analogov. Najbolj značilni predstavniki so predstavljeni na shemi. Puščica prikazuje, kako se spreminja kislost anorganskih dušikovih spojin od močne dušikove(V) kislina, s Ka = 20, do amonijaka, ki je šibka baza, s Kb = 1,8.10-5. Tudi analogi amonijaka, amini, imajo zato bazičen značaj.
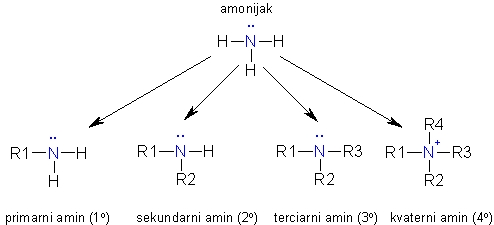
Na shemi je prikazana delitev aminov. Glede na zgradbo organske skupine so amini lahko alifatski, aromatski ali pa heterociklični, kjer je dušikov atom v obroču skupaj z ogljikovimi atomi.
|
Adrenalin je primarni amin.
| |
|
Adrenalin je terciarni amin.
| |
|
Adrenalin je sekundarni amin.
| |
|
Adrenalin je heterociklični amin.
|
| Model molekule adrenalina |
|---|
Primarne amine poimenujemo kot alkilamine (imenu organske skupine dodamo končnico amin) ali kot alkanamine (imenu alkana dodamo končnico amin). Lego −NH2 skupine v molekuli označimo s številko C atoma na katerega je vezana.
Primer: CH3CH2CH2−NH2
Ime: 1-propilamin ali 1-propanamin
Simetrične sekundarne in terciarne amine poimenujemo tako, da dodamo imenu amina grško predpono di-, tri-.
Primer: CH3−NH−CH3
Ime: dimetilamin
Nesimetrične sekundarne in terciarne amine poimenujemo tako, da vključimo v ime veliko črko "N" in stme označimo vezavo organske skupine na dušikov atom.
Primer: CH3CH2−NH−CH3
Ime: N-etil-N-metilamin (upoštevamo abecedni red navajanja organskih skupin, zato N-etil pred N-metilom).
1. CH3CH2−NH−CH2CH3 →
2. CH3CH2CH2CH2−NH2 → ali 1-butanamin
3. CH3CH2CH2NHCH3 →
Poglejte filmski posnetek, ki prikazuje reakcijo med amonijakom in klorovodikovo kislino.
|
|
Na košček filtrirnega papirja smo kanili kapljico koncentriranega amonijaka, na drugi košček pa kapljico koncentrirane klorovodikove kisline. Papirčka podržimo na razdalji nekaj centimetrov in opazujemo, kaj nastane. Bela trdna snov, ki se pojavi kot megla, so drobni kristalčki amonijevega klorida. Model kristalne mreže je prikazan na začetku filmskega posnetka. Če bi amonijak zamenjali z 1-butilaminov, bi bil rezultat poskusa podoben, tudi v tem primeru bi nastala megla soli 1-butilamonijevega klorida. |
Animacija prikazuje, kako iz 1-butilamina in vodikovega klorida nastane sol, 1-butilamonijev klorid. Vodikov klorid odda proton, ki se veže na nevezni elektronski par dušikovega atoma v molekuli 1-butilamina.
Vodni raztopini amonijaka in 1-butilamina z indikatorskim papirčkom izmerimo pH. Pozorno sledite filmskemu posnetku.
pH vodne raztopine amonijaka je: .
pH vodne raztopine 1-butilamina je: .
|
Vzrok za večjo topnost 1-butilamina v primerjavi z butanom je večja molska masa 1-butilamina.
| |
|
Vzrok za večjo topnost 1-butilamina v primerjavi z butanom so vodikove vezi, ki nastajajo med molekulami vode in molekulami 1-butilamina. | |
|
Vzrok za večjo topnost 1-butilamina v primerjavi z butanom je večja polarnost molekul 1-butilamina v primerjavi z molekulami butana.
|
|
Med molekulami 1-butilamina delujejo dipol-dipol interakcije, disperzijske sile in vodikove vezi, zato je vrelišče višje od vrelišča butana.
| |
|
Med molekulami 1-butilamina delujejo močne dipol-dipol interakcije, zato je vrelišče višje, kot je vrelišče butana.
| |
|
1-butilamin ima večjo molsko maso od butana, zato je vrelišče višje.
|
+ HCl → CH3NH3+ + Cl−
CH3CH2NH2 + H2O ↔ CH3CH2NH3+ +
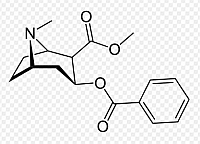
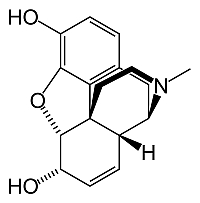
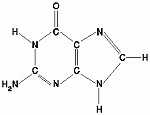
Katero spojino predstavlja spodnja formula?
|
Alkaloid morfin.
| |
|
Eno od organskih baz molekule DNA.
| |
|
Raketno pogonsko gorivo, hidrazin.
| |
|
Alkaloid kokain.
|