Elektronegativnost
Izvedeli boste, kaj je elektronegativnost, in se naučili uporabljati Paulingovo
skalo elektronegativnosti atomov za razlikovanje med značilnimi vrstami
kemijskih vezi med atomi: ionsko, kovalentno polarno in kovalentno nepolarno
vezjo.
Spoznali boste tudi, da nam sodobna informacijsko komunikacijska
tehnologija omogoča predstaviti porazdelitev nabojev na površini molekul in
ionov ter s tem vizualizirati zelo abstraktne kemijske pojme, kot so
polarnost, nepolarnost, prebitek pozitivnega in prebitek negativnega naboja.
Morda boste na koncu tega poglavja premagali strah pred urami kemije, ki je
največkrat pogojen z nerazumevanjem temeljnih kemijskih pojmov.
Svetujemo vam, da učno enoto predelate večkrat, da boste resnično
razčistili vse dvome in razvili globlje razumevanje posredovane vsebine.
|
Januarja 1986
je svet pretresla novica o nesreči vesoljskega plovila Challenger, ki je 73
sekund po vzletu v zraku eksplodiralo, in na tisoče opazovalcev je bilo nema
priča tragične smrti sedmih astronavtov, med njimi tudi učiteljice Kriste
McAuliffe, ki naj bi s svojim dosežkom motivirala mlade za naravoslovje in
raziskovanje. Obsežna preiskava vzrokov nesreče je pokazala, da je šlo sicer za
splet nesrečnih okoliščin, vendar je bil ključni vzrok v strukturnih spremembah
na tesnilu, ki je bilo nameščeno v desnem tanku z gorivom. To je le eden izmed mnogih primerov, ki kaže, kako
pomembno je poznavanje zgradbe materialov in njihovih lastnosti za našo osebno
varnost in lagodno življenje. Zgradbo in lastnosti snovi določa vrsta vezi med
gradniki. V tem poglavju boste spoznali, kako lahko poznavanje elektronegativnosti
atomov elementov pomaga pri napovedovanju vrste vezi med atomi. Pri odkrivanju prave narave kemijske vezi je odigrala pomembno vlogo kvantna mehanika.
S klikom na besedo kvantna mehanika v besedilu
dobite razlago tega pojma v slovenski različici Wikipedije. |

Eksplozija Challengerja, Wikipedia
|
|
Pauling, Wikipedia. Linus Pauling (1901-1994) je bil ameriški znanstvenik in velik humanist, borec za človekove pravice. Je dvakratni dobitnik Nobelevo nagrade; za kemijo in mir. Na osnovi kvantne mehanike je razložil resnično naravo kemijske vezi. |
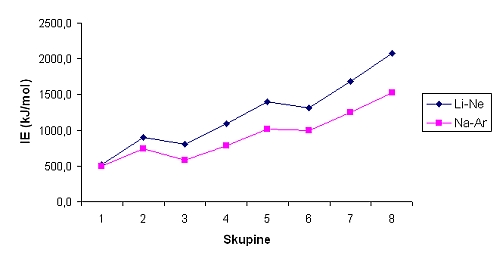
Pojem elektronegativnost
(simbol χ) je uvedel L. Pauling in ga opredelil kot moč
atoma, da pritegne k sebi elektrone v vezi. Poznanih je več definicij
elektronegativnosti. Po Mullikenu je elektronegativnost povprečje ionizacijske
energije atoma in njegove elektronske afinitete. Toda največkrat se
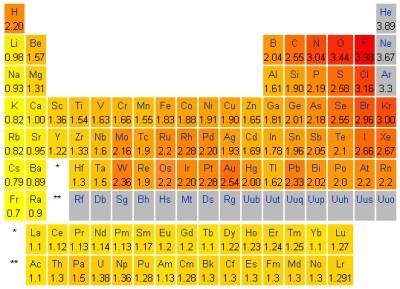
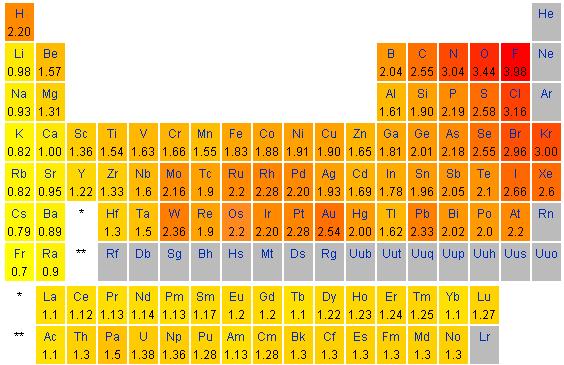
uporablja skala po Paulingu, kjer so navedene relativne vrednosti za
elektronegativnost atomov. Skala je prirejena tako, da je relativna
elektronegativnost atoma vodika χ = 2,1. Relativne vrednosti elektronegativnosti atomov po
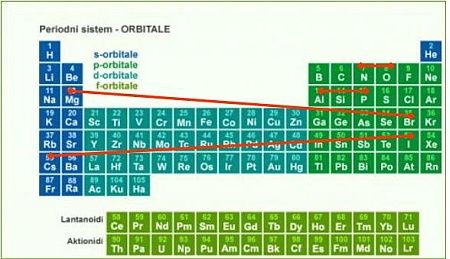
periodah od leve proti desni naraščajo, po skupini pa padajo od zgoraj navzdol.
Najbolj elektronegativen je atom fluora, najmanj pa atom francija. Razlike v
elektronegativnosti dveh atomov lahko ocenimo z uporabo periodnega sistema,
potrebno je le vedeti, kako se elektronegativnost spreminja po periodah in
skupinah.
IUPAC Compendium of Chemical Terminology, 09. 11. 2007
|
Uporabite periodni sistem in rešite nalogo. Upoštevajte, da elektronegativnost po periodah narašča z leve na desno, po skupinah pa pada od zgoraj navzdol.
Ste uspeli pravilno razvrstiti dvojice atomov po padajoči razliki v elektronegativnosti? Če niste, si oglejte rešitev.
Natančneje lahko opredelimo razlike v elektronegativnosti, če uporabimo Paulingovo skalo. S pomočjo Paulingove skale elektronegativnosti (desno spodaj) dopolnite manjkajoče vrednosti. Pri navajanju vrednosti za elektronegativnost uporabljajte decimalno vejico in ne decimalne pike, kot je to označeno v Paulingovi skali.
Pri določanju prevladujoče narave kemijske vezi med dvema atomoma, ki tvorita vez, si pomagamo s pravili.
Pravila:
1. če je razlika elektronegativnosti dveh atomov v vezi manjša kot 0,4 prevladuje nepolarna kovalenta vez,
2. če je razlika elektronegativnosti dveh atomov v vezi večja od 1,7 prevladuje ionska vez,
3. če je razlika elektronegativnosti dveh atomov v vezi med 0,4 in 1,7 prevladuje polarna kovalentna vez,
4. elektronski par v vezi je vedno premaknjen k atomu, ki je bolj elektronegativen.
Izračunajte razliko v elektronegativnosti med atomoma kalcija in broma ter določite prevladujočo naravo kemijske vezi.
Pri navajanju vrednosti za elektronegativnost uporabljajte decimalno vejico in ne decimalne pike.
Dopolnite stavke. Kot pomoč uporabljajte Paulingovo skalo. (Kliknite!)
1. Vez med atomoma kisika in žvepla je polarna .
2. Vez med atomoma ogljika in vodika je kovalentna.
3. Elektronski par v vezi vodik - kisik je premaknjen k atomu .
4. Vez med atomoma kalija in kisika je .
|
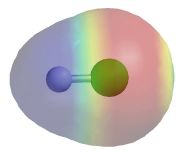
Kliknite na sliko za prikaz animacije.
Porazdeliteve elektronske gostote (elektrostatičnega potenciala) na površini modela molekule HCl.
|
Posledica razlik v elektronegativnosti atomov je nesimetrična ali simetrična porazdelitev nabojev na atomih v molekuli. Porazdelitev nabojev na površini molekule lahko prikažemo z elektrostatičnim potencialom. Globlji pomen elektrostatičnega potenciala boste spoznali tisti, ki se boste odločili za študij kemije. Poenostavljeno ga lahko opredelimo kot prikaz porazdelitve gostote elektronov na površini molekule, ki jo ob pomoči računalniške grafike vizualiziramo. Rdeča barva pomeni vedno negativni elektrostatični potencial, modra pa pozitivni elektrostatični potencial. Na modelu molekule vodikovega klorida vidimo, da je na modelu atoma vodika (manjša kroglica) barva modra, ob modelu atoma klora pa rdeča. To pomeni, da je v molekuli vodikovega klorida na atomu vodika prebitek pozitivnega naboja (d +), na atomu klora je prebitek negativnega naboja (d -). S klikom na sliko bo aktivna animacija, ki razloži, zakaj ravno taka porazdelitev nabojev na molekuli vodikovega klorida. Oglejte si animacijo in razmislite, kaj predstavlja. Preverite ustreznost razmisleka. |
1. Katera trditev je pravilna?
|
Atom silicija je manj elektronegativen kot atom magnezija. | |
|
Atom fluora je najbolj elektronegativen atom v periodnem sistemu.
| |
|
Prevladujoča narava vezi med atomoma ogljika in klora je nepolarna kovalentna vez.
|
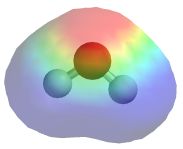
2. Dobro poglejte sliko, ki prikazuje elektrostatični potencial oz. razporeditev elektronske gostote na površini modela molekule vode in
poiščite pravilno trditev.
|
Na atomu kisika je elektrostatični potencial pozitiven.
| |
|
Na obeh atomih vodika je elektrostatični potencial pozitiven.
| |
|
Na atomu kisika je delni pozitivni naboj.
| |
|
Na obeh atomih vodika je delni negativni naboj.
|