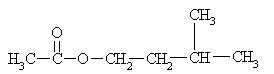Estri
Estri so spojine s -COO- skupino. Podobno skupino imajo karboksilne kisline, le da je pri kislinah -COO- skupina na koncu verige, na en atom kisika je vezan še atom vodika (-COOH skupina), pri estrih pa je -COO- skupina vezana v sredini verige in se z obeh strani veriga nadaljuje (R-COO-R1).
Najenostavnejši ester ima dva ogljikova atoma in je:
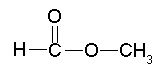
Slika 1: Struktura metil metanoata
S tremi C atomi obstajata dva estra:
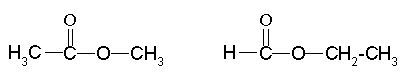
Slika 2: Strukturi metil etanoata in etil metanoata
Najenostavnejši aromatski ester je metil benzoat:
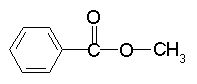
Slika 3: Struktura metil benzoata
Estri nastajajo pri esterifikaciji. Esterifikacija je reakcija med karboksilno kislino in alkoholom (ali fenolom). Reakcija ponavadi poteče ob prisotnosti močne kisline (H2SO4) kot katalizatorja.
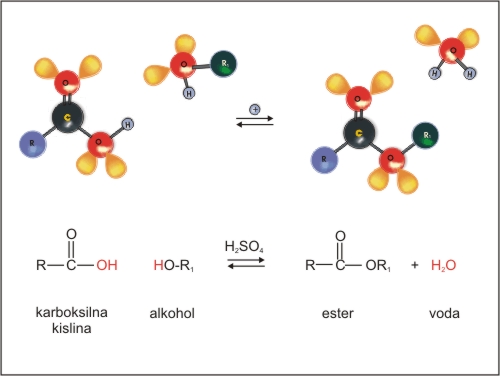
Slika 5: Sinteza estra
Pri esterifikaciji se –OH skupina iz kisline zamenja z –OR1 skupino alkohola, odcepi se voda. Reakcija poteče kot nukleofilna substitucija.
Primer: reakcija med ocetno kislino in metanolom
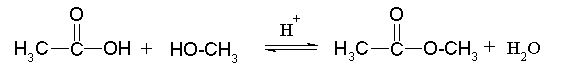
Slika 6: Sinteza metil etanoata
Reakcija esterifikacije je ravnotežna reakcija, pri čemer so v ravnotežju prisotni tako reaktanti kot produkti. Ravnotežje te reakcije lahko pomaknemo v smeri nastanka estra tako, da povečamo koncentracijo alkohola ali z odstranjevanjem enega izmed produktov iz sistema.
Estri in karboksilne kisline so funkcionalni izomeri podobno kot alkoholi in etri ter aldehidi in ketoni.
Pri spojinah, ki imajo poleg karboksilne skupine še hidroksilno lahko poteče intermolekularna esterifikacija, pri čemer nastanejo ciklični estri. Ti so obstojni, če je obroč pet ali šestčlenski.
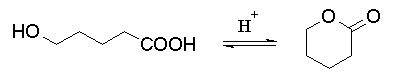
Tabela 1: Nekateri estri po vonju ali po izvoru.
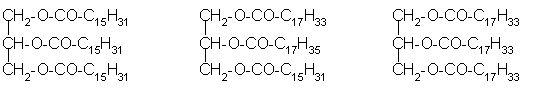
Slika 8: Molekule maščob (trigliceridov):gliceril-tripalmitat, gliceril-oleo-stearo-palmitat in gliceril-trioleat
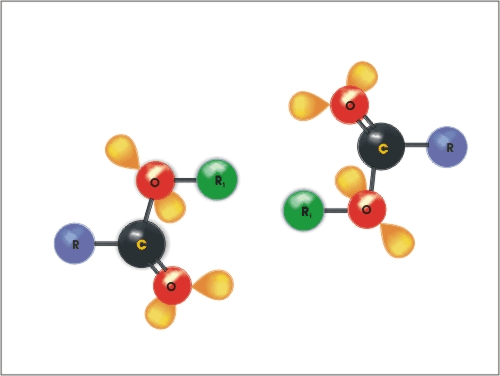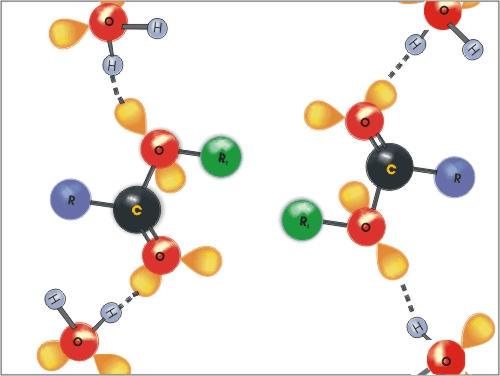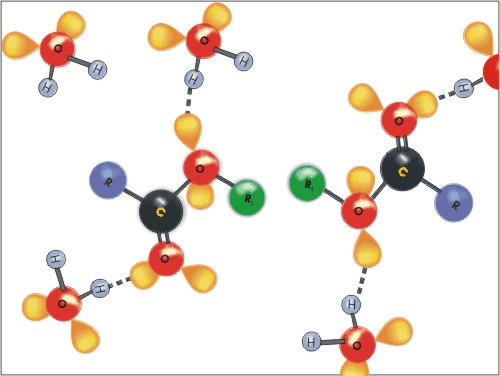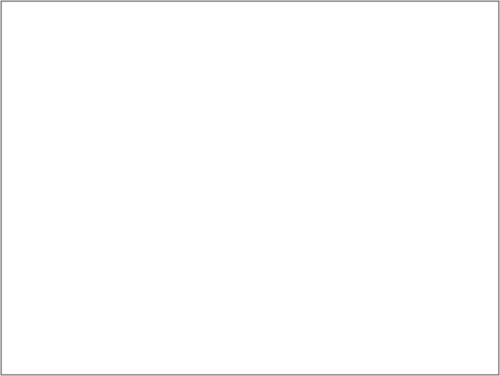
Estri ne morejo tvoriti vodikovih vezi, saj nimajo vodika vezanega na kisikov atom kar je pogoj za tvorbo vodikove vezi. Temperature vrelišč estrov so precej nižje od temperatur vrelišč alkoholov in karboksilnih kislin s podobnimi molskimi masami. Fizikalne lastnosti estrov so podobne fizikalnim lastnostim etrov kot kaže spodnja tabela. Večina nižjih in srednjih estrov so brezbarvne tekočine s prijetnim vonjem.
Tabela 2. Vrelišča estrov v primerjavi z drugimi spojinami
| ime | spojina |
molska masa |
Tv |
| dietil eter | eter | 74 |
34 |
|
etil metanoat |
ester | 74 | 54 |
| metil etanoat | ester |
74 | 57 |
|
butanal |
aldehid | 72 | 76 |
| butan-1-ol | alkohol | 74 | 118 |
|
propanonska kislina |
k. kislina | 74 | 141 |
Topnost
Molekule vode z molekulami estrov lahko tvorijo vodikove vezi. Nižji estri so topni v vodi. Topnost hitro pada z daljšanjem verige.
Slika 14: Topnost estrov – raztapljanje v vodi
Hidroliza estrov je reakcija estra z vodo, pri čemer se molekula cepi, nastaneta karboksilna kislina in alkohol, iz katerih je ester nastal. Hidroliza estrov poteče ob prisotnosti močne kisline ali encimov. Hidroliza estrov je obratna reakcija estrenja (nastanek estrov iz kisline in alkohola).
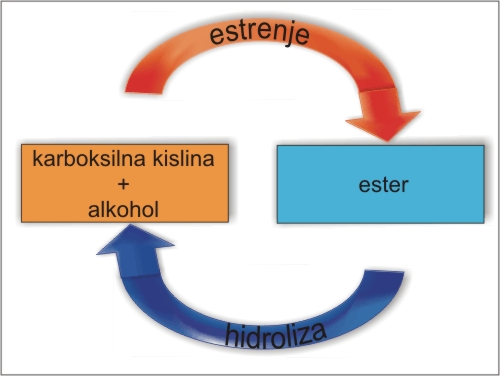
Slika 15: Estrenje in hidroliza
Umiljenje ali saponifikacija je hidroliza organske molekule ob prisotnosti baze, pri čemer kot eden izmed produktov nastaja sol karboksilne kisline. Saponifikacija poteče z estri, amidi, maščobami in olji. Pri saponifikaciji estrov lahko uporabimo tako NaOH kot KOH, produkta pa sta alkohol in sol karboksilne kisline.
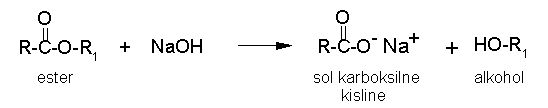
Slika 16: Umiljenje maščob
Hidroliza maščob
Pri hidrolizi maščob (loj, druge živalske masti, rastlinske masti) dobijo glicerol, maščobne kisline in mila.
Hidroliza s kislinami:
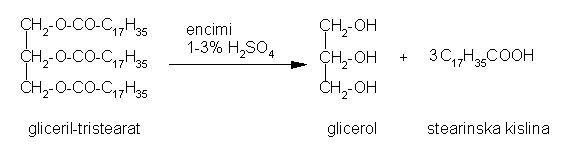
Slika 17: Kislinska hidroliza maščob
Hidroliza z bazami:
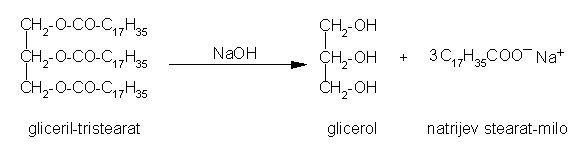
Slika 18. Bazična hidroliza maščob
Druge reakcije estrov
Redukcija:
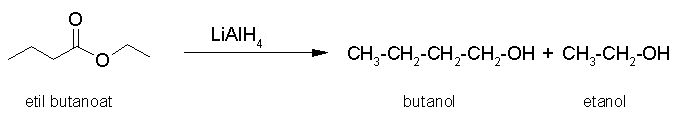
Slika 19. Redukcija estrov
Nukleofilne substitucije:
Zamenjava z alkoholom:
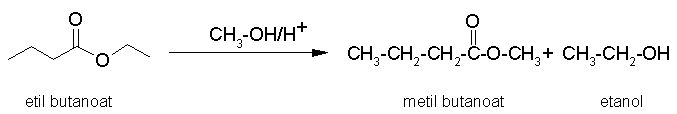
Slika 20. Nukleofilna substitucija z alkoholom
Zamenjava z amini:
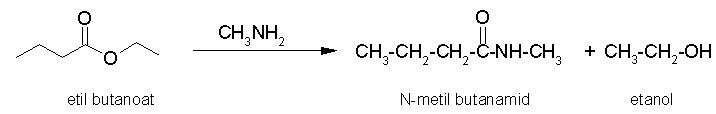
Slika 21. Nukleofilna substitucija z aminom
Poliestri
So produkt reakcije polikondenzacije. Nastajajo iz monomerov, pri čemer se ponavadi odcepi voda. Lastnost monomera je, da ima vsaj dve funkcionalni skupini. V pimeru poliestrov, ko nastane estrska vez, mora imeti monomer hidroksilno in karboksilno skupino ali pa uporabimo dva monomera (kopolimer), enega s hidroksilnima skupinama, drugega s karboksilnima skupinama. Najbolj znan poliester je poli(etilen tereftalat), ki ga poznamo pod oznako PET in nastane iz tereftalne kisline (dikarboksilna kislina) in etilen glikola (dialkohol).

Slika 22: Nastanek PET polimera
Približno 80 % PET se uporablja v tekstilni industriji, 20 % pa za proizvodnjo plastenk. Uporablja pa se tudi v medicini, saj je inerten, zato ga uporabljajo pri zamenjavi poškodovanih delov arterij, pa tudi pri srčnih zaklopkah.
Poliester je tudi polimer, ki se uporablja za razgradljive šive (laktomer) pri različnih operacijah. Sintetizirajo ga iz glikolne kisline in mlečne kisline, ki sta v telesu naravno prisotni. Polimer se v nekaj tednih razgradi na osnovni komponenti.
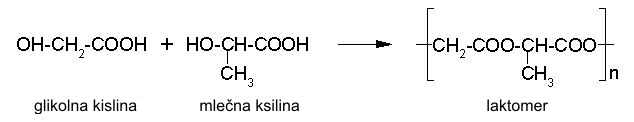
Slika 23: Sinteza laktomera
Estri nastanejo tudi med alkoholi in anorganskimi kislinami:
-estri žveplove kisline
-estri fosforjeve kisline
-estri dušikove kisline
-estri borove kisline
-estri acikličnih karboksilnih kislin
Estri žveplove kisline
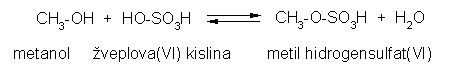
Slika 24: Ester žveplove kisline in metanola
Estri fosforjeve kisline
So zelo pomembni pri presnovnih procesih, mednje prištevamo lecitin in nukleinske kisline. Med estri fosforjeve(V)kisline uvrščamo tudi nekatere insekticide in nevarne živčne bojne strupe, kot so tabun, soman, sarin.
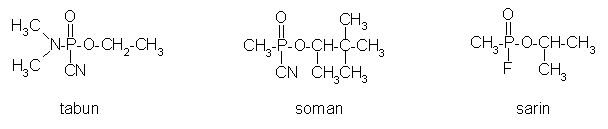
Slika 25: Estri fosforjeve kisline – živčni strupi
Estri dušikove kisline
Verjetno najbolj znan ester dušikove kisline je gliceril trinitrat, ki je eksplozivna tekočina in se uporablja za izdelovanje dinamita.
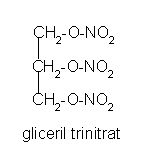
Slika 26: Ester dušikove kisline z glicerolom
Estri borove kisline
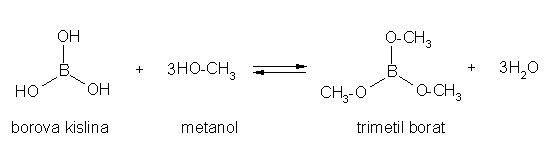
Slika 27: Nastanek borovega estra z metanolom.
1. V spodnjih kislinah ugotovite vrsto alkohola, ki je prisoten v estru (črke pišite po abecednem vrstnem redu).
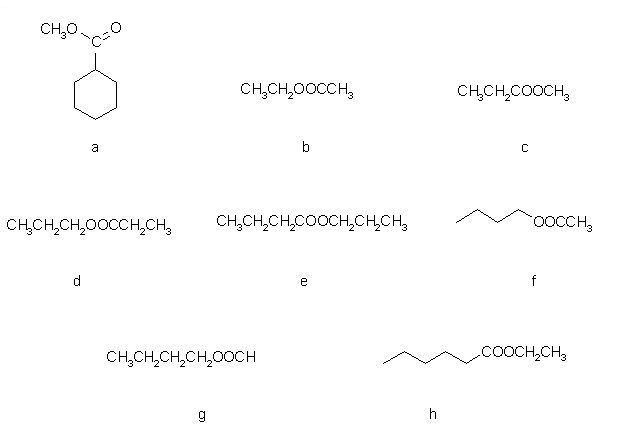
| ime spojine |
črka |
| metanol | , |
| etanol |
,
|
| propanol |
,
|
| butanol |
,
|
2. Med spodnjimi spojinami izberite produkt naslednje reakcije.
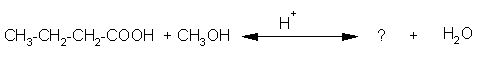
|
CH3CH2CH2CH2COOCH3
| |
|
CH3CH2CH2OOCCH3
| |
|
CH3CH2CH2COOCH3
| |
|
CH3COOCH2CH2CH3
|
3. Izberi črko pod pravim produktom naslednje reakcije.
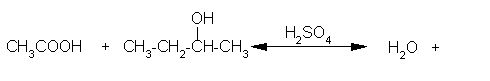
Črka:
4. Razvrsti naslednje estre po naraščajočih vreliščih, 1-najnižje, 4-najvišje.
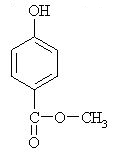
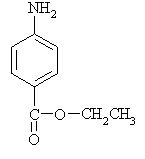
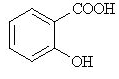
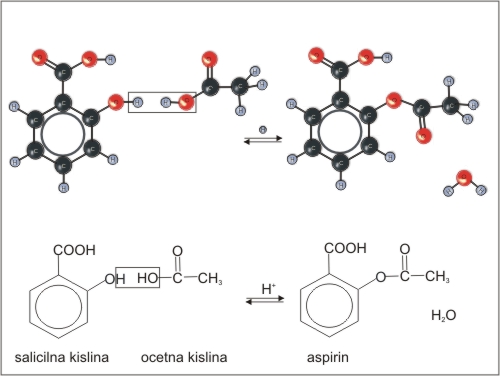
5. Iz katerih spojin lahko sintetiziramo aspirin?
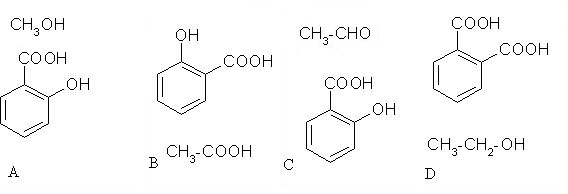
Črka:
7. Kaj nastane pri kisli hidrolizi naslednjega estra?
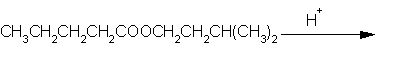
|
butanojska kislina in 2-metilbutan-4-ol
| |
|
pentanojska kislina in 3-metilbutan-1-ol
| |
|
pentanojska kislina in pentan-1-ol
| |
|
pentenojska kislina in butan-1-ol
|
8. Kaj nastane pri bazični hidrolizi naslednjega estra?
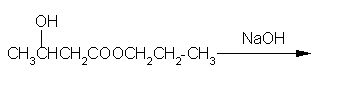
|
natrijev 2-hidroksibutanoat in propan-1-ol
| |
|
natrijev
3-hidroksibutanojska kislina in butan-1-ol
| |
|
natrijev 3-hidroksibutanat in propan-1-ol
| |
|
natrijev
2-hidroksibutanojska kislina in propanol
|
|
Estri imajo v primerjavi s kislinami nižja vrelišča.
| |
|
S hidrolizo estrov lahko dobimo alkohole in
karboksilne kisline.
| |
|
Estri nastanejo pri dekarboksilaciji
karboksilnih kislin.
| |
|
Estri lahko tvorijo z molekulami vode vodikove vezi.
|
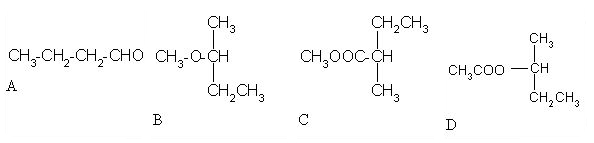
10. Pri redukciji propil propanoata nastaneta spojini A in B. Ugotovi kateri spojini sta to.
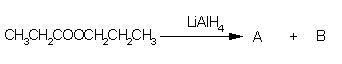
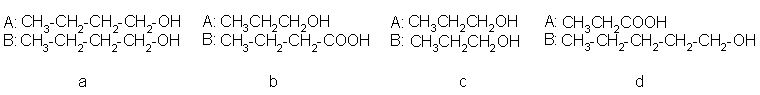
Črka: