Galvanizacija
Spoznati galvanizacijo, to je elektrokemijski postopek zaščite oziroma obdelave kovin.
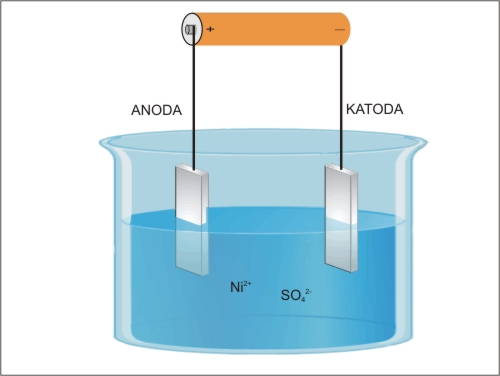
S pomočjo redoks napetostne vrste elementov vemo, da če postavimo cinkovo ploščico v raztopino bakrovih ionov, se bo na površini cinka izločil elementarni baker. Nekaj cinka se zato s površine ploščice raztopi, nastanejo cinkovi ioni, elektroni pa preidejo s cinka na bakrove ione. Med cinkovimi atomi in bakrovimi ioni v raztopini je prišlo do elektrokemijske reakcije.

Slika 1: Potopljena cinkova ploščica v raztopini modre galice
Tudi rjavenje železa je elektrokemijska reakcije. Kapljica vode na površini železa omogoča nastanek galvanskega člena. Pri reakciji sodeluje kisik iz zraka, ki oksidira železo do Fe2+ (anodni - negativni del del). Fe2+ ioni potujejo po kaplici vode in se z raztopljenim kisikom nadalje oksidirajo do Fe3+, nakar se le ta izloči v obliki Fe2O3·H2O, ki je rjavo rdeče barve (rja). Elekroni, ki so nastali na negativnem delu potujejo proti pozitivnemu delu kovine (katoda), na katerem poteka redukcija zračnega kisika.
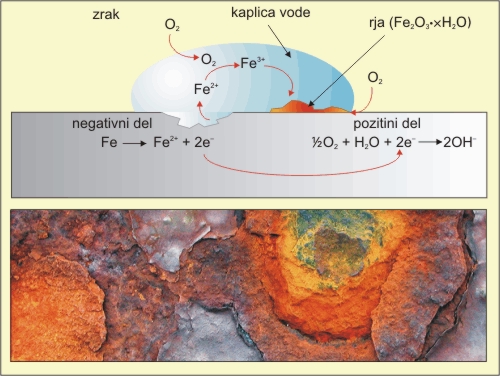
Slika 2: Rjavenje železa
Železo je ena najcenejših
kovin, ki je vsestransko uporabna. Prav rjavenje železa na zraku in vlagi je
največja pomanjkljivost železa. Zato je potrebno železo in druge manj odporne
kovine zaščititi pred vlago, kisikom in drugimi plini ter vodnimi raztopinami.
Pri elektrolizi smo se naučili, da pozitivna anoda in negativna katoda, ki sta priključeni na vir enosmerne napetosti in potopljeni v raztopino elektrolita, privlačita nasprotno nabite delce, kot lahko vidimo iz spodnje slike.
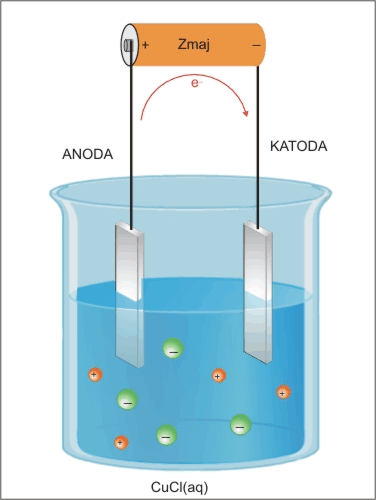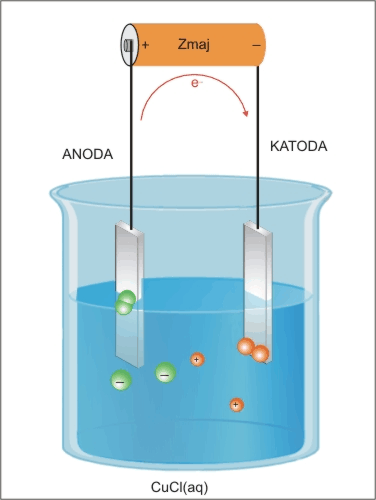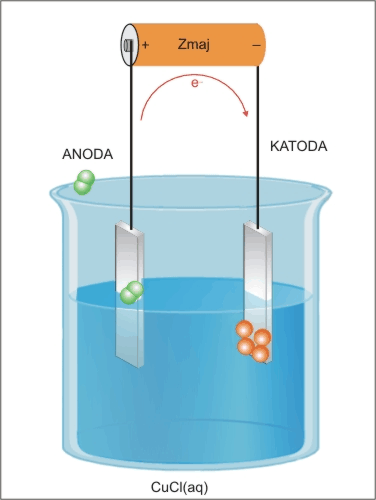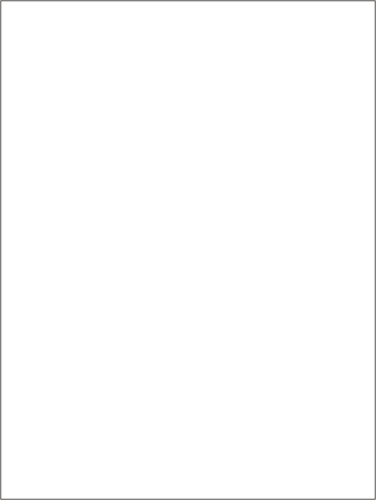
Bakrovi pozitivni ioni (kationi) potujejo na katodo (-), prejmejo elektron in se odlagajo na elektrodi kot atomi bakra, kloridni negativni ioni (anioni) potujejo na anodo (+), oddajo elektron, nastanejo atomi klora, ki se povežejo v molekule Cl2.
Na katodi poteka redukcija:K(−): 2Cu+ + 2e− → 2Cu
Na anodi poteka oksidacija:A(+): 2Cl− → 2e− + Cl2
Katoda se pri tem postopku torej zaščiti ali pa jo zgolj dekoriramo.
Slika 4: Bakrenje kovinskega ključa.
Pri galvanizaciji nanašamo kovinsko plast ene kovine na predmet iz druge kovine s pomočjo elektrolize. Kovinski predmet, ki prevaja električni tok priključimo v elektrolitski celici kot negativno elektrodo - katodo. Na katodo potujejo po raztopini kationi kovine, ki jo želimo izločiti, na njej oddajo elektrone in se izločijo v obliki tanke kovinske plasti. Kot anodo lahko uporabimo ustrezno kovino, ki se pri elektrolizi raztaplja in sprošča v raztopino kovinske katione. V kopeli morajo biti tudi razni dodatki, ki omogočajo enakomerno prevleko in lep sijaj prevleke.
Lahko pa zgoraj opisani postopek uporabimo za čiščenje bakra. Kot anodo uporabimo nečisti baker, ki vsebuje okrog 5 % primesi, za katodo pa uporabimo tanke ploščice čistega bakra. Na anodi se med elektrolizo baker raztaplja in se ponovno izloča na katodi. Na dnu elektrolitske celice ostaja primesi - galvansko blato, ki je lahko vir drugih elementov, kot sta zlato in srebro oziroma elementi, ki se pri tem ne morejo oksidirati. To blato pa lahko zaradi vsebnosti drugih težkih kovin predstavlja velik problem za okolje.
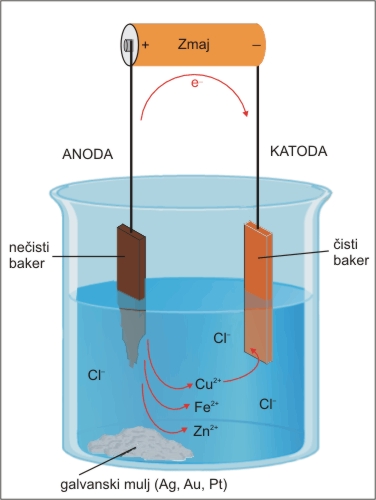
Slika 5: Čiščenja bakra z elektrolizo.
Poleg bakrenja kovin te pogosto zaščitimo s cinkom, nikljem, kositrom, kromom in drugimi kovinami.
Čiščenje odpadnih vod galvanizacije predstavlja velik problem, saj je potrebno vode očistiti v več stopnjah.
Galvanski mulj, ki je bil do nedavnega odpadek in ga je bilo potrebno na poseben način deponirati, v zadnjem času uporabljajo kot sekundarno surovino v gradbeni industriji pri izdelovanju gradbene keramike. Tako se tudi galvanizacija, ki je bila v preteklosti velik onesnaževalec okolja s kovinami zlasti vode in zemlje, postopoma spreminja v bolj čisto industrijsko panogo in s tem doprinaša k varovanju okolja.
|
AgCl | |
|
AgNO3 | |
|
Hg(NO3)2 | |
|
AuCl3
|