Lastnosti karboksilnih kislin - 1. del
Tabela 1:
Nasičene monokarboksilne kisline
| ime (IUPAC) | trivialno ime | formula kisline |
| metanojska kislina |
mravljična kislina |
HCOOH |
| etanojska kislina | ocetna kislina | CH3COOH |
|
propanojska kislina |
metilocetna kislina |
CH3CH2COOH |
|
butanojska kislina |
maslena kislina |
CH3(CH2)2COOH |
| pentanojska kislina |
valerenska kislina |
CH3(CH2)3COOH |
|
heksanojska kislina |
kaprojska kislina |
CH3(CH2)4COOH |
|
heptanojska kislina |
heptojska kislina |
CH3(CH2)5COOH |
|
oktanojska kislina |
kaprilna kislina |
CH3(CH2)6COOH |
|
nonanojska kislina |
pelargonska kislina |
CH3(CH2)7COOH |
|
dekanojska kislina |
kaprinska kislina |
CH3(CH2)8COOH |
|
undekanojska kislina |
CH3(CH2)9COOH |
|
|
dodekanojska kislina |
lavrinska kislina |
CH3(CH2)10COOH |
|
tetradekanojskja kislina |
miristinska kislina |
CH3(CH2)12COOH |
|
heksadekanojska kislina |
palmitinska kislina |
CH3(CH2)14COOH |
|
heptadekanojska kislina |
margarinska kislina |
CH3(CH2)15COOH |
|
oktadekanojska kislina |
stearinska kislina |
CH3(CH2)16COOH |
|
eikozanojska kislina |
arahinska kislina |
CH3(CH2)18COOH |
|
dokozanojska kislina |
behenska kislina |
CH3(CH2)20COOH |
|
tetrakozanojska kislina |
CH3(CH2)22COOH |
Tabela 2: Aromatske karboksilne kisline
| ime (IUPAC) |
trivialno ime |
formula kislina |
| benzenkarboksilna kislina |
benzojska kislina |
C6H5COOH |
| 2-hidroksibenzen karboksilna kislina |
salicilna kislina |
C6H4(OH)COOH |
Tabela 3: Mononenasičene karboksilne kisline
| ime (IUPAC) | trivialno ime | formula kisline |
| Propenojska kislina | akrilna kislina | C3H4O2 |
| (Z)-dodec-9-enojska kislina* |
lauroleinska kislina |
C12H22O2 |
| (Z)-tetradec-9-enojska
kislina |
miristoleinska kislina |
C14H26O2 |
| (Z)-heksadec-9-enojska
kislina |
palmitoleinska kislina |
C16H30O2 |
| (Z)-oktadec-9-enojska
kislina |
oleinska kislina |
C18H34O2 |
| (Z)-12-hidroksioktadec-9-enojska kislina |
ricinolna kislina |
C18H34O3 |
| (Z)-dokoz-13-enojska kislina | eruka kislina |
C22H42O2 |
*(Z) je oznaka, ki je ekvivalentna oznaki cis (Z - zusammmen ali skupaj). Naravne nenasičene maščobne kisline vsebujejo cis dvojne vezi.
Tabela 4: Polinenasičene karboksilne kislina
| ime (IUPAC) | trivialno ime |
formula kisline |
| (Z,Z)-oktadeka-9,12-dienojska kislina |
linolna kislina |
C18H32O2 |
| (Z,Z)-oktadeka-6,9-dienojska kislina |
C18H32O2 | |
| (Z,Z,Z)-oktadeka-9,12,15-trienojska kislina |
alfa-linolenska kislina |
C18H30O2 |
| (Z,Z,Z)-oktadeka-6,9,12-trienojska kislina |
gama-linolenska kislina |
C18H30O2 |
| (Z,Z,Z,Z)-eikoza-5,8,11,14-tetraenojska kislina |
arahidonska kislina |
C20H30O2 |
| (Z,Z,Z,Z,Z)-
dokozo-7,10,13,16,19-pentenojska kislina |
omega3 DPA |
C22H34O2 |
Tabela 5: Dikarboksilne kisline
| ime (IUPAC) |
trivialno ime |
formula kisline |
| etandiojska kislina |
oksalna kislina |
C2H2O4 |
| propandiojska kislina |
malonska kislina |
C3H4O4 |
| butendiojska kislina |
fumarna, maleinska kislina |
C4H4O4 |
| heksandiojska ksilina |
adipinska kislina |
C6H10O4 |
Tabela 6: Polifunkcionalne karboksilne kisline
| ime (IUPAC) |
trivialno ime |
formula kisline |
| 2-oksopropanojska
kislina |
piruvična kislina |
C3H4O3 |
| 2-hidroksipropanojska
kislina |
mlečna kislina |
C3H6O3 |
| 2-hidroksibutandiojska kislina |
jabolčna kislina |
C4H6O5 |
| 2,3-dihidroksibutandiojska kislina |
vinska kislina |
C4H6O6 |
| 2-hidroksi-1,2,3-propantrikarboksilna kislina |
citronska kislina |
C6H8O7 |
1. Spodnje kisline opredelite kot nasičene, nenasičene, polikarboksilne kisline, in hidroksikarboksilne. Črke za posamezne spojine vpišite v spodnjo tabelo (črke vpisujte po abecednem vrstnem redu).
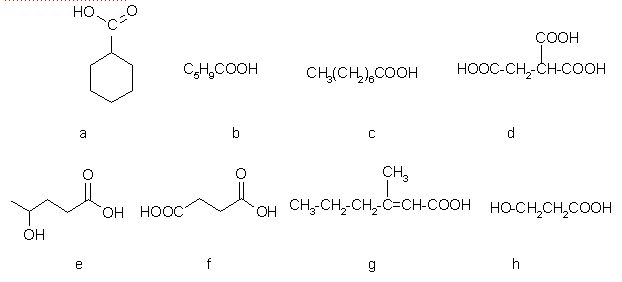
| vrsta kisline |
črka |
| nasičena karboksilna kislina | , |
| nenasičena karboksilna kislina |
,
|
| polikarboksilna kislina |
,
|
| hidroksikarboksilna kislina | , |
| IUPAC | trivialno | |||
| A | butanojska kislina |
A-
|
1 | jabolčna kislina |
| B |
2-hidroksibenzen karboksilna kislina |
B-
|
2 | kaprinska kislina |
| C |
2-hidroksibutandiojska kislina |
C-
|
3 | maslena kislina |
| D |
dekanojska kislina |
D-
|
4 | salicilna kislina |
|
C11H21COOH
| |
|
C17H29COOH
| |
|
CH3(CH2)12COOH
| |
|
C21H41COOH
|
Karboksilna skupina je močno polarna, kar vpliva na fizikalne lastnosti karboksilnih kislin. Zaradi prisotnosti atoma vodika, ki je vezan na kisikov atom (podobno kot v alkoholih), se molekule karboksilnih kislin povezujejo z vodikovimi vezmi. Posledica so visoka vrelišča karboksilnih kislin v primerjavi z alkani in alkoholi s podobnimi molskimi masami.
Tabela 7: Primerjava vrelič butana, propanola in ocetne kisline
| spojina |
molska masa
g/mol
|
Tv
°C
|
|
butan |
58 |
-0,6 |
|
propanol |
60 |
97 |
| ocetna kislina |
60 |
118 |
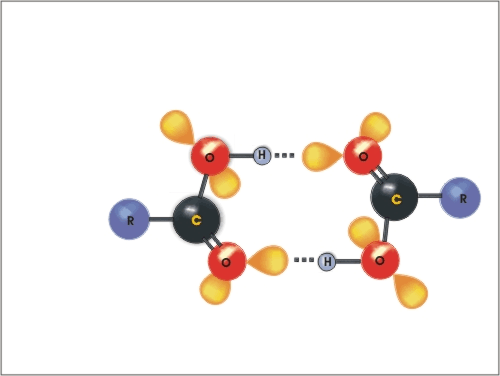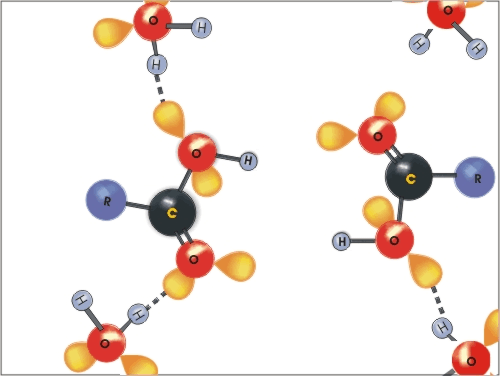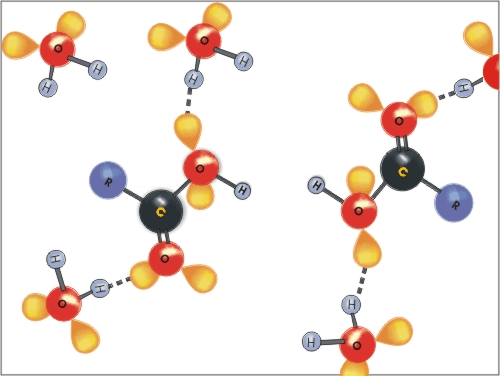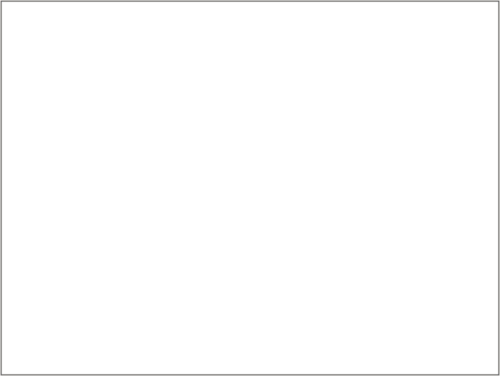
Molekule karboksilnih kislin se med seboj povežejo z dvema vodikovima vezema v dimer, tako je molska masa navidezno dvakrat večja, posledično je višje tudi vrelišče.
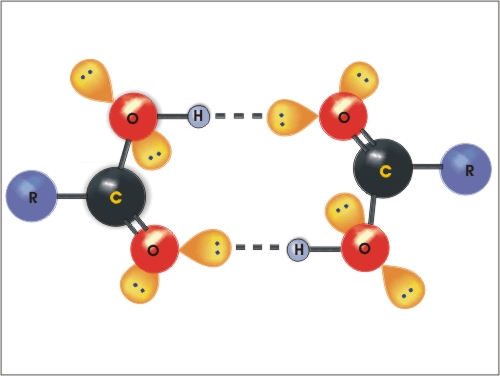
Slika
2: Vodikove vezi med dvema molekulama kislin (dimer)
Tako so nasičene monokarboksilne kisline, ki vsebujejo do 9 C atomov, pri sobnih pogojih tekočine z močnim ostrim vonjem. Kisline z 10 ali več C atomi so voskaste trdne snovi in brez vonja.
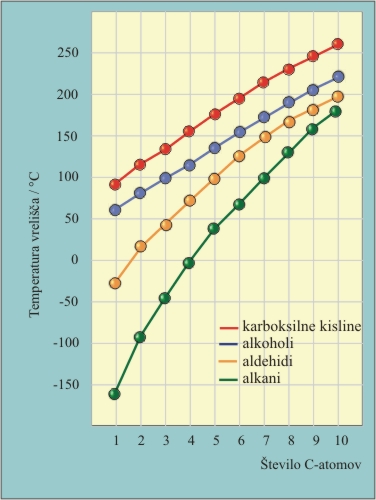
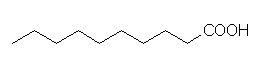
4. Razvrsti dane kisline po vreliščih od najnižjega (1) do najvišjega (4).
 |
|
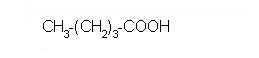 |
|
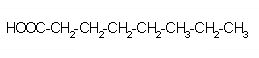 |
|
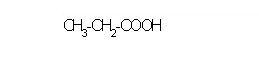 |
|
|
pentan < oktan-1-ol < butanal < metanojska kislina
| |
|
metanojska kislina < butanal < pentan < oktan-1-ol
| |
|
pentan < butanal < metanojska kislina < oktan-1-ol
| |
|
butanal < pentan < metanojska kislina < oktan-1-ol
|
Topnost
Molekule karboksilnih kislin se lahko povezujejo med seboj z vodikovimi vezmi, vodikove vezi pa tvorijo tudi z molekulami vode. Zato so nižje karboksilne kisline (C1 - C4) dobro topne v vodi.
Slika 4: Animacija nastanka vodikovih vezi med molekulami vode in molekulami karboksilne kisline.
Z večanjem števila C-atomov v molekuli pa topnost močno pade. Nasprotno pa prisotnost karboksilnih skupin v molekulah pri di-, tri- in poli-karboksilnih kislinah ali hidroksilnih skupin pri hidroksikarboksilnih kislinah poveča topnost karboksilne kisline v vodi. Aromatske karboksilne kisline večinoma niso topne v vodi.
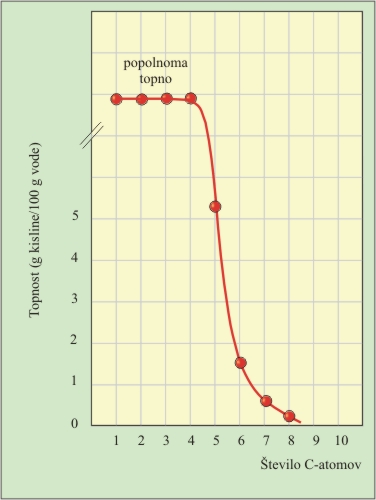
8. Katera kislina bo najmanj topna v vodi?
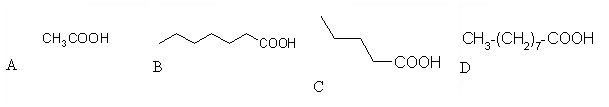
|
Salicilna kislina spada med aromatske kisline.
| |
|
Topnost monokarboksilnih kislin je večja od
dikarboksilnih kislin z enakim tevilom C-atomov..
| |
|
Karboksilne kisline nastanejo z redukcijo aldehidov.
| |
|
Karboksilne kisline imajo nižje vrelišče od alkoholov z enako molsko maso.
|
