Uporaba in vpliv kislin, baz in soli na okolje
| Kisline in baze mnogokrat uporabljamo za čiščenje. Zaradi različnih trdovratnih vrst umazanije uporabljamo za čiščenje pogosto agresivne kemikalije. Kislinska sanitarna čistila so čistila z deležem kisline, ki imajo pH vrednost < 7. V glavnem vsebujejo citronsko, amidosulfonsko ali fosforno kislino. Sanitarna čistila na osnovi mravljinčne, ocetne ali klorovodikove kisline, se zaradi korozivnega učinka ne smejo uporabljati. Veliko čistil vsebuje baze. Blažja čistila vsebujejo raztopino amonijaka, v močnih čistilnih sredstvih pa pa sta prisotna natrijev in kalijev hidroksid. Pri rokovanju s čistili je zato še posebej pomembno, da pazimo na varnost in uporabljamo vsaj zaščitne rokavice. |
Kisline in baze se nahajajo v čistilih |
Kisli dež so kisle padavine, ki jih povzročajo predvsem emisije žveplovega dioksida in dušikovih oksidov v atmosferi. Omenjeni plini se raztapljajo v vodi v zraku in jo naredijo kislo.
Kisel dež povzroča poškodbe na rastlinah ter ostalih živih bitjih, pa tudi na stavbah in spomenikih.
Pomemben učinek kislega dežja je tudi sprememba kemijskega ravnovesja v tleh. Rastline, ki rastejo v takih tleh, so zaradi pomanjkanja določenih rudninskih snovi dovzetnejše za bolezni. Tudi reke in jezera postanejo zaradi kisle deževnice kisla, zaradi česar nastanejo nove življenjske razmere, na katere se mnoge rastline in živali ne morejo tako hitro prilagoditi.
Včasih se plini neposredno absorbirajo v jezerski vodi, v rastlinah in zidovih zgradb.
Navedeni plini lahko prepotujejo po zraku tudi po 500 kilometrov na dan, zato onesnaženje s kislim dežjem ne pozna meja.
Oglejte si poskus in dopolnite spodnje besedilo
Potrebujemo aparaturo za pridobivanje kisika. Plin kisik pridobimo z razgradnjo vodikovega peroksida. V presesalno erlenmajerico z vodno raztopino kvasa po kapljicah dodajamo vodno raztopino . Opazimo nastajanje plina kisika, ki ga uvajamo v erlenmajerico, napolnjeno z vodo. Ko je erlenmajerica napolnjena s plinom kisikom, jo zapremo z aluminijasto folijo. Na urno steklo si pripravimo žveplo. Na kovinsko žličko damo malo , ga prižgemo v plamenu gorilnika in damo v erlenmajerico s plinom kisikom. Opazimo, da žveplo gori z plamenom.
V erlenmajerici imamo sedaj plin, ki je nastal pri gorenju žvepla v kisiku. V erlenmajerico dodamo destilirano , da raztopimo pri gorenju nastali žveplov dioksid in pomešamo. V raztopino nato dodamo nekaj kapljic raztopine lakmusa in ponovno premešamo. Opazujemo spremembo barve indikatorja v raztopini. Produkt, nastal pri gorenju žvepla, je v vodi topen. Lakmus se obarva , nastala raztopina je .
S poskusom smo ugotovili, da so produkti, nastali pri gorenju žvepla v kisiku, v vodi topni in da je nastala raztopina .
Oglejte si še animacijo ionizacije kisline v vodi in dopolnite enačbo reakcije.
Molekula klorovodikove kisline v vodi razpade na vodikov ion ter na kislinski preostanek. Vodikov ion (proton) se v raztopini veže na molekulo vode, pri čemer nastane oksonijev ion, H3O+.
Dopolnite naslednjo enačbo reakcije:
HCl + H2O →
+ Cl–
HNO3 + H2O → H3O+ +
|
Nastane pri gorenju žveplovega sulfida.
| |
|
Pri sobnih pogojih je rumen prah.
| |
|
V vodi je slabo topen.
| |
|
Pri raztapljanju v vodi tvori kislo raztopino.
|
Katera trditev velja za molekulo spojine, katere model je predstavljen na spodnji sliki?

|
Model predstavlja molekulo vode.
| |
|
Spojino sestavljajo štirje različni atomi.
| |
|
Spojina se pri sobnih pogojih nahaja v trdnem agregatnem stanju.
| |
|
Spojina se uporablja kot sestavina čistil.
|
Apnenec
|
Apnenec je najpogostejša oblika kalcijevega karbonata (CaCO3). Pokrajine, ki so iz apnenca, so sedimentnega izvora
in so nastale z nalaganjem skeletov mehkužcev na dno nekdanjih morij. Je zelo trd in odporen in ga uporabljajo v gradbeništvu, pri proizvodnji cementa, iz njega delajo tudi steklo. |
 |
Če ga segrevamo, se razkroji. Pri tem nastane žgano apno (kalcijev oksid).

Po dodatku vode kos kalcijevega oksida nabrekne in iz njega se začne kaditi. Pri tem se drobi v bel prah, kalcijev hidroksid. Dobimo gašeno apno (Ca(OH)2), ki se uporablja v gradbeništvu in pleskarstvu.
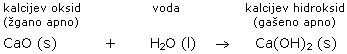

Gašeno apno se uporablja
za pripravo malte v gradbeništvu.
Belež, ki se uporablja za uničevanje škodljivcev in dezinfekcijo, se uporablja v
pleskarstvu. Prav tako lahko pridobivamo številne kemične proizvode, steklo
itn.
Uporaba soli za posipanje cest
Sol (natrijev klorid) se uporablja za posipanje cest pri temperaturi do –8 °C. Mokro soljenje (mešanica soli in raztopine kalcijevega klorida ali magnezijevega klorida) učinkuje do temperature –18 °C in je namenjeno za preventivno posipavanje, predvsem pa za preprečevanje in odstranjevanje poledice.
V spodnji tabeli so zbrana
najpomembnejša področja uporabe nekaterih soli.
| Sol |
Uporaba |
| amonijev klorid | baterije |
| amonijev sulfat |
gnojilo |
| kalcijev karbonat |
proizvodnja cementa, stekla |
| kalcijev klorid |
sušilno sredstvo |
| kalcijev sulfat |
proizvodnja mavca (v
zdravstvu) |
| kalijev nitrat |
gnojilo |
| natrijev karbonat |
proizvodnja pralnih praškov, mehčanje vode |
| natrijev klorid |
prehrana (kuhinjska sol), proizvodnja klorovodikove kisline |
| natrijev stearat |
proizvodnja mil |
| srebrov bromid |
fotografija |
| natrijev hidrogenkarbonat |
zobna krema |
Mavec v zdravstvu
Približno tako obliko imobilizacij, kot so današnje, so začeli uporabljati v 19. stoletju, že stari Egipčani pa so uporabljali pri zdravljenju zlomov platnene povoje, ki so jih utrjevali z različnimi premazi, da bi dosegli negibljivost poškodovanih udov.
Kaj je mavec?
Po kemični sestavi je mavec kalcijev sulfat (CaSO4). V naravni obliki vsebuje 21 % kristalne vode. Ko ga pečemo na 130 °C, izgubi tri četrtine vode, pri 145 °C pa vso kristalno vodo. Če se tako pečen (dehidriran) mavec namoči v vodo, se spremeni v mehko maso, ki jo je lahko oblikovati. Čas strjevanja in sušenja mavca je odvisen od vrste in kvalitete mavca.
|
natrijev karbonat
| |
|
kalcijev sulfat
| |
|
natrijev hidrogenkarbonat
| |
|
kalcijev oksid
| |
|
kalcijev karbonat
|
| natrijev klorid | |
| amonijak | |
| kalijev hidroksid | |
| kalcijev sulfat | |
| klorovodikova kislina |
Formulam spojin v levem stolpcu pripišite ustrezno črko, ki se nahaja pred imenom spojine v desnem stolpcu.
| CaCO3(s) |
|
A. kalcijev karbonat |
| CaO(s) |
|
B. amonijak |
| Na2CO3(s) |
|
C. žgano apno |
| NH3(g) |
|
D. mavec |
| CaSO4(s) |
|
E. natrijev karbonat |
| proizvodnja mavca (v zdravstvu) | A. natrijev klorid | |
| zobna krema | B. kalcijev sulfat | |
| fotografija |
|
C. kalcijev karbonat |
| proizvodnja cementa, stekla |
|
D. srebrov bromid |
| prehrana (kuhinjska sol) |
|
E. natrijev hidrogenkarbonat |
