Kisle in bazične snovi
Spoznajmo lastnosti vodnih raztopin kislin.
Oglejmo si enostaven eksperiment, ki prikazuje, kaj se zgodi z
navlaženim modrim lakmusovim papirjem, če ga držimo nad steklenico s
koncentrirano klorovodikovo kislino.
Kaj opazimo?
Če nad steklenico s konc. klorovodikovo kislino držimo navlažen moder lakmusov papir, ta postane rdeč.
Pojasnimo opažanja: Iz raztopine koncentrirane klorovodikove kisline
izhajajo molekule plina vodikovega klorida HCl, ki se na navlaženem
indikatorskem papirju raztopi v vodi. Raztopljene molekule vodikovega
klorida nato reagirajo z molekulami vode. Pri tem nastanejo H3O+ ioni (oksonijevi ioni).
Zaradi prisotnosti oksonijevih ionov H3O+ je raztopina kisla. Kisle raztopine obarvajo moder lakmusov papir rdeče.
V kislih vodnih raztopinah so prisotni naslednji delci:
SUBMIKRO in MAKRO RAVEN
Kako nastane oksonijev ion?
SUBMIKRO RAVEN - Zapis reakcije z modeli:
 |
+ | 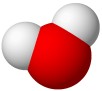 |
 |
+ |
 |
Oglejmo si animacijo nastanka oksonijevega iona.
Molekula klorovodikove kisline odda molekuli vode vodikov ion H+ (proton). Pri tem nastaneta oksonijev ion H3O+ in kloridni ion Cl−.
Podobno velja tudi za druge kisline. Oksonijevi ioni H3O+ so prisotni v vseh kislih raztopinah.
ZAPOMNIMO SI:
Kisline so snovi, ki oddajajo protone. V vseh kislih vodnih raztopinah so prisotni oksonijevi ioni H3O+.
SIMBOLNI NIVO:
Enačba reakcije med klorovodikovo kislino in vodo:
|
|
H+ |
|
||||
| HCl(aq) | + |
H2O(l) |
H3O+(aq) |
+ | Cl−(aq) | |
|
molekula |
molekula
vode
|
oksonijev
ion
|
kloridni
ion
|
Molekula klorovodikove kisline odda molekuli vode vodikov ion H+ (proton). Pri tem nastaneta oksonijev ion H3O+ in kloridni ion Cl−.
V vodni raztopini klorovodikove kisline HCl ni molekul te kisline, temveč so samo molekule vode in prosto gibljivi ioni. To so oksonijevi ioni H3O+ in kloridni ioni Cl−. Kisline, pri katerih razpadejo v vodi vse molekule na ione so močne kisline. Klorovodikova kislina je močna kislina.
Odgovor na naše začetno vprašanje, zakaj so vodne raztopine nekaterih snovi kisle, je:
vodne raztopine nekaterih snovi so kisle, ker so v njih prisotni oksonijevi ioni H3O+.
|
sprejemajo vodikove ione | |
|
vsebujejo hidroksidne ione
| |
|
oddajajo protone
|
|
hidroksidnih ionov
| |
|
vodikovih atomov
| |
|
oksonijevih ionov
| |
|
kisikovih atomov |
Skica prikazuje delce, prisotne v vodni raztopini neke snovi.
Dopolni zapis za simbole delcev , ki so prisotni v vodni raztopini z njihovimi formulami.
SUBMIKRO in MAKRO RAVEN
Rešitev:
− ion, + ion ter molekule
so snovi, ki oddajajo protone. V vseh kislih vodnih raztopinah so prisotni ioni, Te ione zapišemo s formulo
Spoznajmo lastnosti bazičnih vodnih raztopin.
Oglejmo si enostaven eksperiment, ki prikazuje, kaj se zgodi z navlaženim rdečim lakmusovim papirjem, če ga držimo nad steklenico s koncentrirano raztopino amonijaka.
Kaj opazimo?
Če nad steklenico s koncentrirano raztopino amonijaka s pinceto držimo navlažen rdeč lakmusov papir, ta postane moder.
Pojasnimo opažanja: iz raztopine s koncentrirano raztopino amonijaka izhajajo molekule plina amonijaka NH3, ki se na navlaženem indikatorskem papirju raztopijo v vodi. Raztopljene molekule amonijaka nato reagirajo z molekulami vode. Pri tem nastanejo OH− ioni (hidroksidni ioni), ki obarvajo rdeč lakmusov papir modro.
Zaradi prisotnosti hidroksidnih ionov je raztopina bazična.
V katerih vodnih raztopinah so še prisotni OH− ioni (hidroksidni ioni) ?
V vodo vržemo granulo natrijevega hidroksida, NaOH. V vodi se natrijev hidroksid dobro topi, njegovi kristali razpadejo na ione, zato so v vodnih raztopinah natrijevega hidroksida prisotni natrijevi ioni Na+ in hidroksidni ioni OH−. Zaradi prisotnosti hidroksidnih ionov je tudi raztopina natrijevega hidroksida bazična.
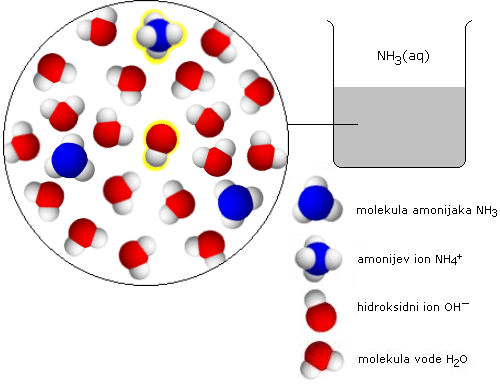
V bazičnih vodnih raztopinah so prisotni naslednji delci:
SUBMIKRO in MAKRO RAVEN
Kako nastane hidroksidni ion?
MIKRO NIVO - Zapis reakcije z modeli:
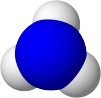 |
+ |  |
 |
+ |
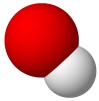 |
Oglejmo si animacijo nastanka hidroksidnega iona.
Molekula amonijaka sprejme od molekule vode vodikov ion H+ (proton). Pri tem nastaneta amonijev ion NH4+ in hidroksidni ion OH¯.
Hidroksidni ioni OH¯ so prisotni v vseh bazičnih vodnih raztopinah.
ZAPOMNIMO SI :
Baze so snovi, ki sprejemajo protone. V vseh bazičnih vodnih raztopinah so prisotni hidroksidni ioni OH¯.
Oglejmo si enačbo reakcije med molekulo amonijaka in molekulo vode:
|
|
H+ |
|
||||
| NH3(aq) | + |
H2O(l) |
|
NH4+(aq) |
+ | OH –(aq) |
|
molekula |
molekula
vode
|
amonijev
ion
|
hidroksidni
ion
|
Molekula amonijaka sprejme proton (H+) od molekule vode. Pri tem nastaneta amonijev ion NH4+ in hidroksidni ion OH –.
Vendar v vodni raztopini amonijaka prevladujejo molekule amonijaka, ker le malo molekul amonijaka razpade na ione. Zato pravimo, da je vodna raztopina amonijaka šibko bazična.
Odgovor na naše začetno vprašanje, zakaj so nekatere vodne raztopine snovi bazične je:
Vodne raztopine nekaterih snovi so bazične, ker so v njih prisotni hidroksidni ioni OH¯.
|
oddajajo vodikove ione
| |
|
sprejemajo protone
| |
|
vsebujejo kisikove atome
| |
|
oddajajo protone
|
|
hidroksidnih ionov
| |
|
kisikovih atomov
| |
|
oksonijevih ionov
| |
|
kloridnih ionov |
Dopolni zapis za simbole delcev, ki so prisotni v vodni raztopini z njihovimi formulami.
Rešitev:
¯ ion, + ion in molekule in NH3.