Dvojna in trojna kovalentna vez
Spoznali boste dvojno in trojno kovalentno vez ter nastanek molekule kisika in dušika.
Znali boste ločiti med veznimi in neveznimi elektronskimi pari.
Atomi, ki imajo v zunanji lupini 6 elektronov, potrebujejo za dosego stabilne razporeditve
elektronov v zunanji lupini še dva elektrona. Vsak tak atom lahko v skupno vez
z drugim atomom prispeva dva elektrona in tako doseže, da ima v zunanji lupini po osem elektronov. Tako
doseže tako razporeditev elektronov v
zunanji lupini, kot jo imajo atomi žlahtnih plinov.
Atoma si med seboj delita oba elektrona in se tako
z dvojno kovalentno vezjo med seboj
povežeta.
Med
katerimi atomi nastane dvojna kovalentna vez?
Elektrona, ki tvorita enojno kovalentno vez, imenujemo tudi skupni ali vezni elektronski
par. Z dvojno kovalentno vezjo se med seboj povezujejo atomi nekovin, ki imajo v
zunanji lupini šest elektronov – atomi šestnajste skupine periodnega sistema (po starem VI skupine).
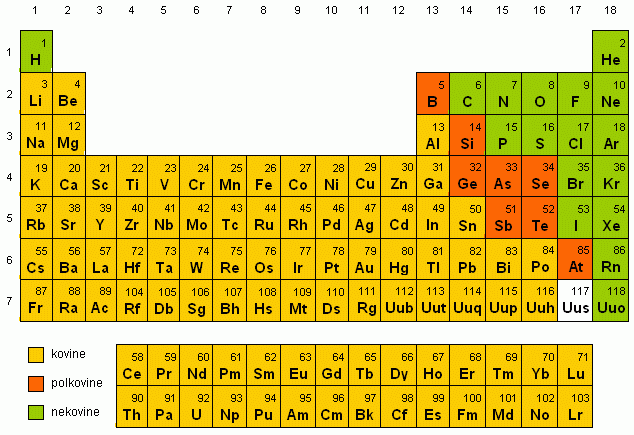
Nekovine
se nahajajo na desnem delu periodnega sistema.
Oglejmo si Periodni sistem elementov!
Oglejmo
si enostaven primer nastanka dvojne kovalentne vezi.
Zakaj se dva atoma kisika povežeta v molekulo kisika?
Oglejmo si animacijo prikaza nastanka dvojne kovalentne vezi:
RAZLAGA:
Kisikov atom ima v zunanji lupini 6 elektronov. Da bi atom kisika imel zunanjo lupino polno, potrebuje še dva elektrona. Vsak kisikov atom v skupno vez prispeva dva elektrona. Kisikova atoma si oba elektrona delita, tako imata torej oba kisikova atoma po osem elektronov v zunanji lupini. Kisikova atoma si tako delita dva skupna ali vezna elektronska para, zato se lahko tvorita dve kovalentni vezi. Vsak atom kisika ima še dva elektronska para, ki jih pri nastanku omenje vezi ni potreboval, zato ima nastala molekula kisika štiri samske ali nevezne elektronske pare.
Na skici je prikazan skupni ali vezni elektronski par med atomoma vodika:
![]()
Strukturna formula in model molekule kisika
Zapomnimo si!
V molekuli kisika sta atoma kisika povezana z eno dvojno kovalentno vezjo.
|
dvema poljubnima atomoma.
| |
|
med dvema atomoma, ki imata v zunanji lupini dva
elektrona manj kot žlahtni plin neon.
| |
|
dvema atomoma dušika.
| |
|
ne more nastati med atomi posameznih elementov.
|
Dvojna kovalentna vez nastane tako, da vsak atom v skupno vez z drugim atomom prispeva in tako doseže, da ima v zunanji lupini po elektronov. Tako oba atoma dosežeta tako razporeditev elektronov v lupini, kot jo imajo atomi plinov.
Pravilno Nepravilno
Pravilno Nepravilno
Pravilno Nepravilno
Kje v periodnem sistemu se nahajajo atomi nekovin, ki potrebujejo še dva elektrona, da bi imeli zunanjo lupino polno?
Z skupnima ali veznima elektronskima paroma se med seboj povezujeta dva kisika v molekulo kisika O2. Tvorita se lahko kovalentni vezi.
Oglej si animacijo prikaza nastanka dvojne kovalentne vezi in ovrednoti pravilnost trditev.
Animacija prikaza nastanka dvojne kovalentne vezi:
Pravilno Nepravilno
Pravilno Nepravilno
Pravilno Nepravilno
| Model molekule kisika |
Oglejmo si prikaz nastanka trojne kovalentne vezi.
RAZLAGA:
Ko se atoma dušika
dovolj približata, si pričneta deliti svoje tri elektrone. Tako nastane iz dveh atomov dušika molekula dušika.
Zapomnimo si!
V molekuli dušika sta atoma dušika povezana z eno trojno kovalentno vezjo.
| Model molekule dušika |
Ponovno si oglej si animacijo prikaza nastanka trojne kovalentne vezi in dopolni besedilo. Vpisuj povedi in ne števil.
Vsak atom ima v zunanji lupini pet zunanjih elektronov. Ko se atoma dušika dovolj približata, si pričneta svoje elektrone. Pri tem nastane kovalentna , ki poveže atoma dušika med seboj. Nastala je dušika s formulo N2 .
|
V molekuli kisika sta
med seboj povezana dva atoma kisika z trojno vezjo.
| |
|
Molekula kisika ima tri samske
ali nevezne elektronske pare.
| |
|
V molekuli kisika si
kisikova atoma delita dva skupna ali vezna elektronska para.
| |
|
Molekula kisika je
sestavljena iz atomov različnih elementov.
|
|
ker ima vsak atom dušika
dva zunanja elektrona.
| |
|
ker atoma dušika tako
dosežeta polno zunanjo lupino.
| |
|
ker iz atoma dušika
nastanejo stabilnejši delci ioni.
| |
|
ker je molekula dušika
manj stabilna.
|
