Standardna sprememba entalpije pri reakciji
Standardna reakcijska entalpija 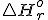 je merilo za toploto, ki se sprosti ali porabi pri
kemijski reakciji pri standardnem tlaku 1 bar. Standardno reakcijsko entalpijo
lahko izračunamo s pomočjo standardnih tvorbenih entalpij spojin, ki v reakciji
nastopajo.
je merilo za toploto, ki se sprosti ali porabi pri
kemijski reakciji pri standardnem tlaku 1 bar. Standardno reakcijsko entalpijo
lahko izračunamo s pomočjo standardnih tvorbenih entalpij spojin, ki v reakciji
nastopajo.
Standardna tvorbena entalpija 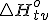 je sprememba entalpije pri reakciji, pri kateri nastane spojina iz elementov, iz katerih je sestavljena.
je sprememba entalpije pri reakciji, pri kateri nastane spojina iz elementov, iz katerih je sestavljena.
Pri računanju standardne reakcijske entalpije seštejemo najprej standardne tvorbene entalpije vseh produktov, od te vsote pa odštejemo standardne tvorbene entalpije reaktantov. Upoštevati pa moramo tudi množino n posamezne spojine v skupni reakciji, s katerim moramo pomnožiti ustrezne standardne tvorbene entalpije.
|
Reakcija nastanka tekoče
vode iz elementov pri standardnih pogojih je eksotermna.
| |
|
Če hočemo en mol vode pri
standardnih pogojih razgraditi na elemente, potrebujemo 286 kJ energije.
| |
|
Pri nastanku enega mola
vode iz elementov se sprosti 572 kJ energije.
| |
|
Pri
nastanku enega mola vode iz elementov se sprosti 286 kJ energije.
|
Oglejte si poskus in odgovorite na spodnja vprašanje.
Uredite enačbo za reakcijo oksidacije
metanola, ki ste jo videli.
CH3OH(l) +
O2(g) →
CO2(g) +
H2O(l)
|
− 72,5 kJ/mol
| |
|
− 74,8 kJ/mol
| |
|
− 149,6 kJ/mol
| |
|
+ 74,8 kJ/mol
|
| Spojina |
H2O(l) | C2H6(g) |
C6H12O6(s),
|
CaCO3(s) | NH3(g) |
| Standardna tvorbena entalpija / kJ mol−1 | − 286 | − 84,7 | − 1274 | − 1207 | − 46,1 |
CaC2(s) + H2O(l) → Ca(OH)2(s) + C2H2(g)
Al(OH)3(s) →
Al2O3(s) +
H2O(g)

