Urejanje enačb redoks reakcij
Spoznali boste, kako urejamo enačbe redoks reakcij. Pri tem nam je v pomoč oksidacijsko število. Znati moramo določiti oksidacijska števila elementov, ki pri reakciji sodelujejo, ugotoviti spremembe oksidacijskih števil in na tej osnovi urediti enačbo za redoks reakcijo.
Spoznali bomo reakcijo med aluminijem in bromom.
Poskus
Očiščeno površino aluminija damo v tekoč brom. Poteče burna reakcija, pri kateri nastane aluminijev bromid s formulo Al2Br6.
Oksidacijsko število aluminija kot elementa je , oksidacijsko število aluminija v nastalem produktu je .
Oksidacijsko število broma v molekuli broma je , oksidacijsko število broma v nastalem produktu je .
Pri tem se je aluminij , brom pa . Pri redoks reakcijah je število oddanih elektronov številu elektronov. Pri tej reaciji je aluminij , brom pa .
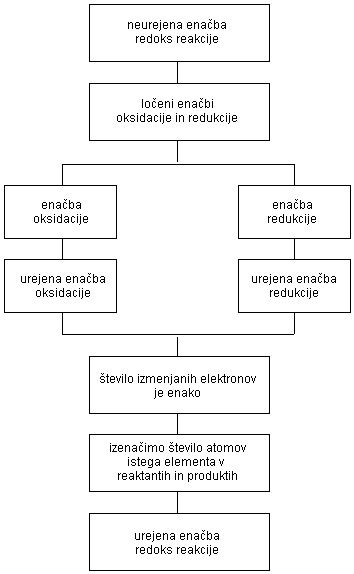
- Napišemo neurejeno enačbo za reakcijo, to pomeni formule reaktantov in produktov.
- Če so pri redoks reakciji reaktanti spojine, se največkrat spremeni oksidacijsko število samo enemu elementu v spojini. Ugotovimo, katerim elementom v reaktantih in produktih se spremeni oksidacijsko število.
- Ugotovimo, katera snov se reducira in katera oksidira in izračunamo število sprejetih in oddanih elektronov. Pri tem sta nam lahko v pomoč ločeni enačbi za oksidacijo in za redukcijo. Iz njih je razvidno število sprejetih oziroma oddanih elektronov.
- Kadar število oddanih elektronov ni enako številu sprejetih elektronov, poiščemo najmanjši skupni večkratnik s pomočjo katerega uredimo enačbo.
- Preverimo, če je v urejeni enačbi število atomov posameznih elementov v reaktantih in produktih enako.
- Če v redoks reakciji sodelujejo tudi ioni, mora biti skupen naboj reaktantov enak skupnemu naboju produktov.
Dopolni.
Na segret bakrov(II) oksid CuO uvajamo vodik. Pri tem nastane elementaren baker in vodna para.
Oksidacijsko število bakra v bakrovem(II) oksidu je , elementarnega bakra pa . Baker se je pri reakciji . Dopolni enačbo za prehod bakrovih ionov v elementaren baker.
Cu2+ + e- → Cu
Oksidacijsko število vodika v molekuli H2 je , v nastali vodi pa . Vodik se je pri reakciji . Dopolni enačbo za prehod molekul vodika v vodikove ione.
H2 → H+ + e-
Atom bakra sprejme elektrona, molekula vodika odda elektrona. Število sprejetih in oddanih elektronov je .
Enačba redoks reakcije:
(s) + H2(g) →
(s)
+
(g)
Poskus
Vodni raztopini kalijevega manganata(VII) dodamo vodno raztopino kalijevega hidroksida in nato vodno raztopino natrijevega sulfata(IV). Pri tem se vijolična barva raztopine kalijevega manganata(VII) spremeni v zeleno. Nastal je kalijev manganat(VI). Pri reakciji nastane tudi natrijev sulfat(VI) in voda. Pri reakciji prikazani na filmu je bil uporabljen natrijev hidrogensulfat(VI) namesto natrijevega sulfata(VI).
Dopolni.
Formula kalijevega manganata(VII) je . Formula kalijevega manganata(VI) je K2MnO4. Oksidacijsko število mangana se je pri reakciji spremenilo od na . Mangan v kalijevem manganatu(VII) en elektron in se pri tem .
Mn7+ + e- → Mn6+
Formula natrijevega sulfata(IV) je . Formula natrijevega sulfata(VI) je . Oksidacijsko število žvepla se je pri reakciji spremenilo od na . Žveplo v natrijevem sulfatu(IV) 2e- se pri tem .
S+4 → S+6 + 2e-
Število oddanih elektronov enako številu sprejetih elektronov. Da bo število izmenjanih elektronov enako, se pri reakciji reducirata dva atoma mangana v kalijevem manganatu(VII) in oksidira en atom žvepla v natrijevem sulfatu(IV).
Enačba redoks reakcije:
+ Na2SO3 + 2 KOH → + Na2SO4 + H2O
Pri reakciji reagirata mol kalijevega manganata(VII) z mol natrijevega sulfata(IV).
2 mol kalijevega manganata(VII) 2 mol elektronov (2 . elektronov)
1 mol natrijevega sulfata(IV) 2 mol elektronov (2 . elektronov)
Število oddanih elektronov je enako številu sprejetih elektronov.
|
Zn + 2 HCl → ZnCl2 + H2
| |
|
Fe + S → FeS
| |
|
CaO + H2O → Ca(OH)2
| |
|
Mg + ZnCl2 → Zn + MgCl2
|
|
S2- → HS-
| |
|
S → H2S
| |
|
SO2 → HSO3-
| |
|
SO3 → HSO4-
|
|
N2(g)
| |
|
O3(g)
| |
|
H3PO4 konc.
| |
|
Ar(g)
|
|
Na(s)
| |
|
C(s)
| |
|
H2SO4 konc
| |
|
CO(g)
|